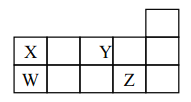
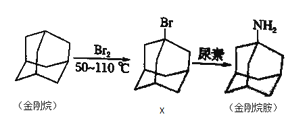
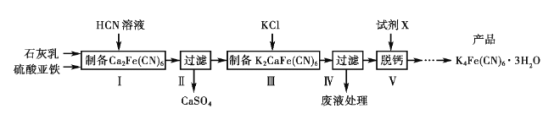
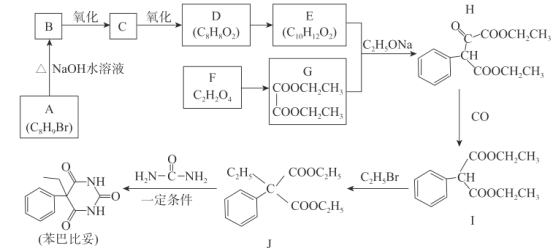
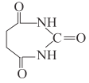
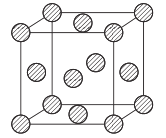
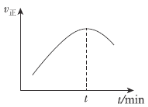
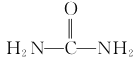0 197384 197392 197398 197402 197408 197410 197414 197420 197422 197428 197434 197438 197440 197444 197450 197452 197458 197462 197464 197468 197470 197474 197476 197478 197479 197480 197482 197483 197484 197486 197488 197492 197494 197498 197500 197504 197510 197512 197518 197522 197524 197528 197534 197540 197542 197548 197552 197554 197560 197564 197570 197578 203614