【题目】根据表中信息判断,下列选项不正确的是( )
序号 | 反应物 | 产物 |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | MnO | Cl2、Mn2+ |
A. 第①组反应的其余产物为H2O和O2
B. 第②组反应中参加反应的Cl2与FeBr2的物质的量之比为1∶2
C. 第③组反应中生成1 mol Cl2,转移电子 2 mol
D. 氧化性由强到弱顺序为MnO![]() >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
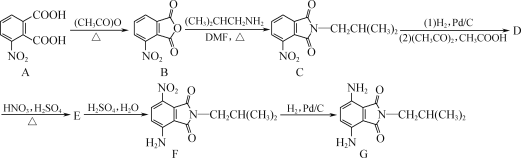
【题目】为充分利用资源,变废为宝,实验室里利用废铁屑制取硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]。某兴趣小组以废铁屑制得硫酸亚铁铵后,按下列流程制备二水合草酸亚铁(FeC2O4·2H2O),进一步制备高纯度还原铁粉。

已知:FeC2O4·2H2O难溶于水,150℃开始失结晶水;H2C2O4易溶于水,溶解度随温度升高而增大。请回答下列问题:
(1)步骤②中,H2C2O4稍过量的主要原因是________。
(2)为了提高步骤③得到的FeC2O4·2H2O的纯度,宜用________(填“热水”“冷水”或“无水乙醇”)洗涤,检验洗涤是否干净的操作是________。
(3)实现步骤④必须用到的两种仪器是________(供选仪器:a. 烧杯;b. 坩埚;c. 蒸馏烧瓶;d. 高温炉;e. 表面皿;f. 锥形瓶)。
(4)为实现步骤⑤,不宜用碳粉还原Fe2O3,理由是________。
(5)硫酸亚铁铵是重要的工业原料,其溶解性如表所示:
10 | 20 | 30 | 40 | 50 | 60 | |
(NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
FeSO4·7H2O | 40.0 | 48.0 | 60.0 | 73.3 | — | — |
(NH4)2Fe(SO4)2·6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
(注意:高于73.3℃,FeSO4·7H2O发生分解)
以铁屑(有油污)、硫酸、硫酸铵为原料,补充制取硫酸亚铁铵晶体的实验方案:将铁屑置于锥形瓶中,______,冷却,过滤,用蒸馏水洗涤铁屑至中性,将铁屑置于锥形瓶中,_____至铁屑完全溶解,_____,冷却结晶,用无水乙醇洗涤2~3次,低温干燥。[实验中必须使用的试剂:铁屑、1.0 mol·L-1的Na2CO3溶液、3.0 mol·L-1的H2SO4溶液,饱和(NH4)2SO4溶液]