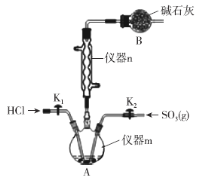
【题目】Ⅰ.用序号回答:①HCl ②NaOH ③Cl2 ④H2O ⑤NH4Cl ⑥P4 ⑦NH3· H2O ⑧Na2O2 ⑨HClO ⑩CaO HF MgCl2。
(1)只存在离子键的是____________________
(2)属于共价化合物的是____________________
(3)既存在离子健又存在共价键的是____________________
Ⅱ.同学们已经学习了同位素、同系物、同素异形体、同分异构体,你能区别这些概念吗?下面列出了几组物质,请将物质的合适组号填写在下表中。
①![]() 和
和![]() ; ②CH3C(CH3)2CH3和
; ②CH3C(CH3)2CH3和![]() ;
;
③CH4和CH3CH2CH3; ④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3)。
类别 | 同位素 | 同系物 | 同素异形体 | 同分异构体 |
组号 | ________ | ___________ | ________ | _______ |
【题目】(1)乙基叔丁基醚(以ETBE表示)是一种性能优良的高辛烷值汽油调和剂。用乙醇与异丁烯(以IB表示)在催化剂HZSM-5催化下合成ETBE,反应的化学方程式为:C2H5OH(g)+IB(g)=ETBE(g) △H。回答下列问题:
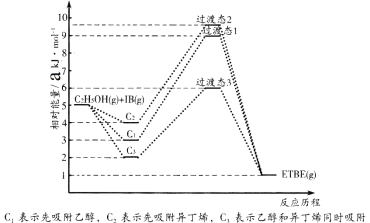
反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如图所示,该反应的△H=__________ kJ·mol-1。反应历程的最优途径是________(填C1、C2或C3)。
(2)开发清洁能源是当今化工研究的一个热点问题。二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
反应ⅰ:CO(g)+2H2(g)CH3OH(g) ΔH1=-99kJ·mol1
反应ⅱ:2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol1
反应ⅲ:CO(g)+H2O(g)CO2(g)+H2(g) ΔH3=-41.2kJ·mol1
①在该条件下,若反应1的起始浓度分别为:c(CO)=0.6mol·L1,c(H2)=1.4mol·L1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为__________。
②在t℃时,反应2的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c(mol·L1) | 0.46 | 1.0 | 1.0 |
此时刻v正___v逆(填“>”“<”或“=”),平衡时c(CH3OCH3)的物质的量浓度是___。
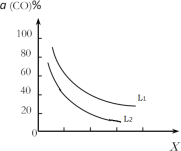
③催化反应室的总反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),CO的平衡转化率α(CO)与温度、压强的关系如图所示,图中X代表___(填“温度”或“压强”),且L1___L2(填“>”“<”或“=”)。
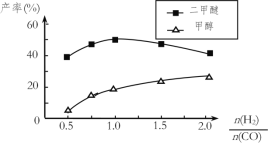
④在催化剂的作用下同时进行三个反应,发现随着起始投料比![]() 的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:______________。
的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:______________。
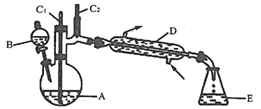
【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略)如图:
![]()
![]()
![]()
有关物质的物理性质见表。
物质 | 沸点(℃) | 密度(g·cm3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中,55~60℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的名称为___________。
(2)酸性Na2Cr2O7溶液氧化环己醇反应的H<0,反应剧烈将导致体系温度迅速上升,副反应增多。
①滴加酸性Na2Cr2O7溶液时反应的离子方程式__________;
②蒸馏不能分离环己酮和水的原因是____________。
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是_____________;
②b中水层用乙醚萃取的目的是___________;
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有_______,操作d中,加入NaCl固体的作用是____________。
(4)恢复至室温时,分离得到纯产品体积为6mL,则环已酮的产率____________。(计算结果精确到0.1%)