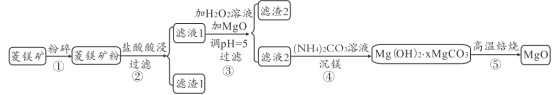
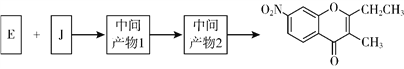
【题目】连二亚硫酸钠(Na2S2O4)是印刷行业重要的还原剂,易溶于水,难溶于乙醇;高铁酸钾(K2FeO4)是一种绿色环保型饮用水处理剂。某课题小组拟以硫铁矿(主要成分是FeS2)为主要原料制备连二亚硫酸钠和高铁酸钾,其简易工艺流程如下(部分步骤和条件略去):
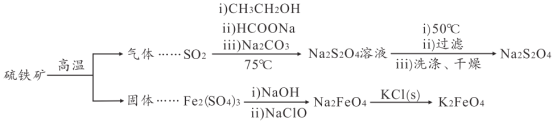
(1)FeS2中含有S22-离子,其电子式为_____。“气体”的主要成分是O2、SO2和N2,参考表中的数据,简述工业上用物理方法分离提纯二氧化硫的实验方案:_____
熔点/℃ | 沸点/℃ | 密度/gL-1(标准状况) | |
O2 | -218 | -183 | 1.429 |
SO2 | -76 | -10 | 2.9 |
N2 | -210 | -196 | 1.25 |
(2)SO2→Na2S2O4步骤中氧化剂与还原剂的物质的量之比为_____。制得的Na2S2O4溶液冷却至50℃,过滤,用_____洗涤,干燥,制得Na2S2O4。
(3)Na2FeO4与KC1发生复分解反应制备K2FeO4,说明相同温度下K2FeO4的溶解度_____(填“ > ”、“ < ”或=”) Na2FeO4的溶解度。
(4)溶液中的Na2S2O4易被空气中的氧气氧化生成NaHSO3,反应的离子方程式为_____
(5)在制备Na2FeO4时,现象是先生成红褐色沉淀,随后转化成绿色溶液,生成了 Na2FeO4。
①写出红褐色沉淀转化为Na2FeO4的化学方程式:_____。
②为探究Na2FeO4和Cl2的氧化性相对强弱,取少量上述绿色溶液于试管中,滴加适量浓盐酸,产生能使湿润的KI淀粉试纸变蓝色的气体,不能说明Na2FeO4的氧化性比Cl2的氧化性强,理由是_____。
【题目】Ⅰ. 实验室制得气体中常含有杂质,影响其性质检验。
下图A为除杂装置,B为性质检验装置,完成下列表格:

序号 | 气体 | 反应原理 | A中试剂 |
① | 乙烯 | 溴乙烷和NaOH的醇溶液加热 | _____________ |
② | 乙烯 | 无水乙醇在浓硫酸的作用下加热至170℃反应的化学方程式是_________________ | ___________ |
③ | 乙炔 | 电石与饱和食盐水反应 | _______________ |
Ⅱ. 为探究乙酸乙酯的水解情况,某同学取大小相同的3支试管,分别加入以下溶液,充分振荡,放在同一水浴加热相同时间,观察到如下现象。
编号 | ① | ② | ③ |
实验操作 |
|
|
|
实验现象 | 酯层变薄 | 酯层消失 | 酯层基本不变 |
(1)试管①中反应的化学方程式是________________________;
(2)对比试管①和试管③的实验现象,稀H2SO4的作用是______________;
(3)试用化学平衡移动原理解释试管②中酯层消失的原因_____________。