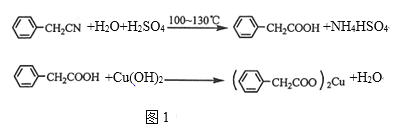
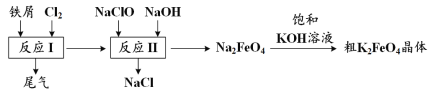【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革 污泥中Cr(III)的处理工艺流程如下。
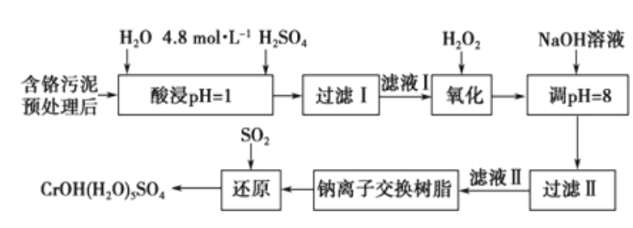
已知:①硫酸浸取后溶液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+;
②CrOH(H2O)5SO4难溶于水。
(1)浓H2O2溶液的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:____________。
(2)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | - | - | - |
沉淀完全时的pH | 3.7 | 11.1 | 5.2 | 5.6 |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为Cr2O42-,其离子方程式为______________________。此步骤中滤液的pH调至8,通过沉淀除去的金属离子为___________;此步骤中没有继续调高将Mg2+除去,理由是______________________。
(3)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用该方法主要除去的滤液II中的Mg2+, 若测得滤液II通过钠离子交换柱后溶液中c(Na+)为amol/L,则滤液II中c(Mg2+)为___________。
(4)写出上述流程中用SO2进行还原时发生反应的离子方程式:_________________________________。
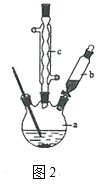
【题目】某小组同学为探究H2O2、H2SO3、Br2的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。

实验记录如下:
实验操作 | 实验现象 | |
Ⅰ | 打开活塞a,滴加氯水,关闭活塞a | A中溶液变为红棕色 |
Ⅱ | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化 |
Ⅲ | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
请回答下列问题:
(1)A中反应的离子方程式是______。
(2)实验操作Ⅱ吹入热空气的目的是_____。
(3)装置C的作用是_____,C中盛放的药品是_____。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式是_____。
(5)由上述实验得出的结论是______。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可)______。