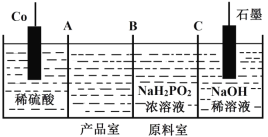
【题目】下表所列的是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089nm)。
元素代号 | A | B | C | D | E |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
(1)比较A、B、E三种元素的简单离子的离子半径大小___(用对应元素离子符号表示)。
(2)A元素简单离子的结构示意图为__,B元素位于周期表中第__周期__族。
(3)B的最高价氧化物对应水化物与C的最高价氧化物对应水化物反应的离子方程式为__。
(4)上述五种元素的最高价氧化物对应水化物中酸性最强的是__(填化学式)。
(5)C、E形成的化合物为__(填化学式)。
(6)用电子式表示A和D形成化合物的过程___。
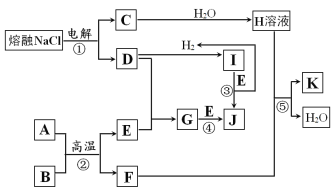
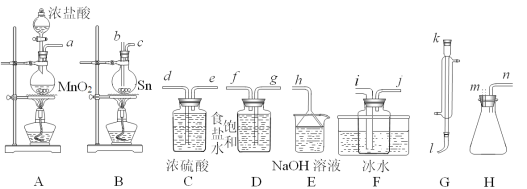
【题目】四氯化锡(SnCl4)常作有机合成的催化剂,在空气中极易水解生成SnO2·xH2O,实验室用熔融的锡(熔点为231.9℃)与氯气反应来制备(同时有SnCl2生成),该反应是放热反应。可选用的仪器及装置如图所示。
SnCl2、SnCl4有关物理性质如表:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 623 |
SnCl4 | 无色液体 | -33 | 114 |
(1)已知SnCl2、SnCl4晶体类型相同,SnCl2熔沸点高于SnCl4的原因是:___。
(2)选择装置进行连接(填各接口的字母,装置可重复使用,空格可不填满)。___
a→__,__→__,__→__,__→__,__→__,__→__,__→__,__→__。
(3)反应开始时,应先点燃装置___(填“A”或“B”,下同)的酒精灯,待___时,再点然装置___的酒精灯,并在反应进行中仍持续加热,其目的是___。
(4)该方法制得的SnCl4中含有少量SnCl2,提纯SnCl4的实验名称是___。
(5)测定产品纯度。取ag产品溶于少量浓盐酸,加入蒸馏水稀释至250mL。取20mL稀释溶液于锥形瓶,滴加几滴淀粉溶液,用cmol·L-1I2溶液滴定至终点,消耗滴定溶液V mL。
①该产品中SnCl2含量为___%。(滴定反应:Sn2++I2=Sn4++2I-,SnCl2的相对分子质量为:190)
②若操作时间过长、振荡剧烈,测得产品中SnCl4含量__(填“偏高”或“偏低”或“无影响”)。
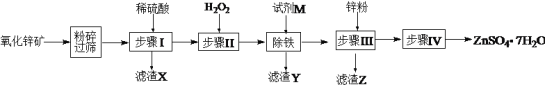
【题目】七水硫酸锌别名皓矾,常用作媒染剂、收敛剂、木材防腐剂。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO4·7H2O的流程如下:
在该流程中,相关离子生成氢氧化物的pH如表:
开始沉淀时pH | 完全沉淀时pH | |
Zn2+ | 5.4 | 6.4 |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Cu2+ | 5.6 | 6.4 |
请回答下列问题:
(1)粉碎氧化锌矿石的目的是______________;滤渣X的成分是________________。
(2)步骤Ⅱ中加入H2O2目的是:_______________,发生反应的离子方程式为:______________。
(3)“除铁”步骤中加入试剂M调节溶液的pH,试剂M可以是________(填化学式,一种即可),控制溶液的pH范围为:_________。同时还需要将溶液加热,其目的是:__________。
(4)滤渣Z的成分是____________。
(5)取28.70 g ZnSO4·7H2O(相对分子质量:287)加热至不同温度,剩余固体的质量变化如图所示:
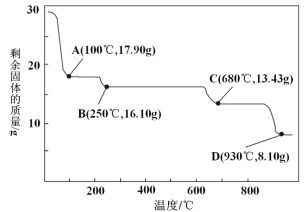
①步骤Ⅳ中的烘干操作需在减压条件下进行,其原因是____________。
②680 ℃时所得固体的化学式为________________。
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4·H2O