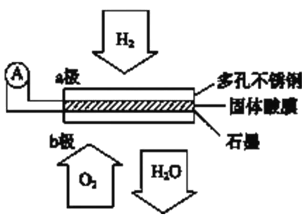
【题目】一种用富锰渣(主要成分为MnCO3以及Fe、Ba及Al的盐类或氧化物及少量重金属盐等)制备MnCl2的工艺流程如下:

回答下列问题:
(1)“溶浸”时,为了提高锰的浸取率,列举2条有效的措施:___________,写出该步中MnCO3参与反应的化学方程式:__________。
(2)“氧化”时,主要反应的离子方程式为______________。
(3)滤渣2的主要成分为______(填化学式);简述产生该滤渣的原理:______。
(4)已知部分重金属硫化物的溶度积如表:
硫化物 | MnS | PbS | CuS | NiS |
Ksp | 1.32×10-10 | 1.32×10-27 | 1.32×10-35 | 2.82×10-20 |
①“除重金属”时,溶液的pH调到4.5~6.0,pH不宜过低的原因是_______。
②若表中四种金属离子浓度相同,滴入Na2S溶液时首先被沉淀的离子是_______,反应MnS(s)+Cu2+(aq)![]() CuS(s)+Mn2+(aq)的平衡常数K=______。
CuS(s)+Mn2+(aq)的平衡常数K=______。
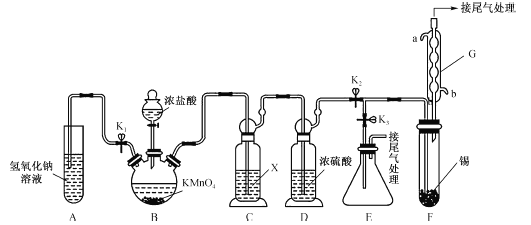
【题目】四氯化锡可用作媒染剂,有机合成中氯化的催化剂等。某学习小组设计了如图所示的装置(夹持和加热仪器省略)制备无水四氯化锡。反应原理是Sn+2Cl2=SnCl4。
已知:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 247 | -33 |
沸点/℃ | 623 | 114 |
其他性质 | 无色晶体,易被氧化 | 无色液体,易水解 |
请回答下列问题:
(1)装置G的名称为__________,该装置的进水口为__________(填“a”或“b”)。
(2)装置B中发生反应的离子方程式为__________。
(3)装置C的作用是除去氯化氢,所用试剂X的名称是_________。
(4)按图连接好装置,检查装置气密性,关闭K1、K3,打开K2,慢慢滴入浓盐酸,待观察到装置F内充满黄绿色气体后,开始加热装置F,当装置F中的固体完全消失,充满SnCl4气体时,将生成的SnCl4排入接收器E中的操作是:停止加热装置F,关闭分液漏斗活塞,__________,再用洗耳球从G的上出口向装置内吹气。
(5)某同学认为装置F中的反应可能产生SnCl2杂质。下列试剂中,可用于检测反应是否产生了SnCl2的有__________(填字母)。
a.FeCl3溶液(滴有KSCN) b.H2O2溶液 c.溴水 d.AgNO3溶液
(6)SnCl4能溶解一定量的氯气,若制取3 kg SnCl4(含氯气的质量分数为13.0%,假设不含除氯气外的其他杂质),则至少需通入氯气的体积(标准状况下)是__________m3(保留两位小数)。