【题目】一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应2SO2(g)+O2(g)![]() 2SO3(g) H=-196kJ·moL1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g) H=-196kJ·moL1,一段时间后达平衡,反应过程中测定的部分数据见下表:
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法不正确的是
A. 反应在前5min的平均速率为v (SO2)=0.08mol·L1·min1
B. 保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v (正)> v (逆)
C. 该温度,反应的平衡常数为11.25L·mol-1
D. 相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%
【题目】下列实验过程可以达到实验目的的是
选项 | 实验目的 | 实验过程 |
A | 制备Fe(OH)胶体 | 将NaOH浓溶液滴加到饱和FeCl溶液中 |
B | 除去Cu粉中混有的CuO | 加入稀硝酸溶液,过滤、洗涤、干燥 |
C | 探究维生素C的还原性 | 向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
D | 配制0.4000mol·L的NaOH溶液250mL | 称取4.0 g固体NaOH于烧杯中,加入少量蒸馏水溶解,立刻转移至250 mL容量瓶中定容 |
A.AB.BC.CD.D
【题目】某同学利用下图进行喷泉实验,已知圆底烧瓶内充满X气体,胶头滴管内装有少量Y液体,烧杯内装有足量Z液体,下列组合能进行喷泉实验且最终液体一定能充满整个烧瓶的是( )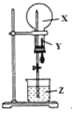
X气体 | Y试剂 | Z试剂 | |
A. | NO2 | H2O | H2O |
B. | CO2 | H2O | H2O |
C. | HCl | 饱和食盐水 | 水 |
D. | NO2 和O2 | H2O | H2O |
A.AB.BC.CD.D