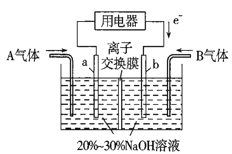
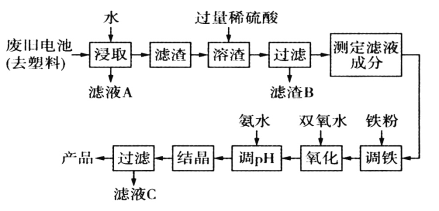
0 196737 196745 196751 196755 196761 196763 196767 196773 196775 196781 196787 196791 196793 196797 196803 196805 196811 196815 196817 196821 196823 196827 196829 196831 196832 196833 196835 196836 196837 196839 196841 196845 196847 196851 196853 196857 196863 196865 196871 196875 196877 196881 196887 196893 196895 196901 196905 196907 196913 196917 196923 196931 203614