【题目】对甲烷和 CO2 的高效利用不仅能缓解大气变暖,而且对日益枯竭的石油资源也有一定的补充作用,甲烷临氧耦合 CO2 重整反应有:
反应(i):2CH4(g)+O2(g)2CO(g)+4H2(g) △ H=-71.4kJmol-1
反应(ii):CH4(g)+CO2(g)2CO(g)+2H2(g) △ H=+247.0 kJmol-1
(1)写出表示 CO 燃烧热的热化学方程式:_____。
(2)在两个体积均为 2L 的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下进行反应(ii):CH4(g)+CO2(g)2CO(g)+2H2(g) (不发生其它反应),CO2的平衡转化率如表所示:
容器 | 起始物质的量(n) / mol | CO2的平衡转化率 | |||
CH4 | CO2 | CO | H2 | ||
Ⅰ | 0.1 | 0.1 | 0 | 0 | 50% |
Ⅱ | 0.1 | 0.1 | 0.2 | 0.2 | / |
①下列条件能说明反应达到平衡状态的是_____。
A.v正(CH4) =2v逆(CO)
B.容器内各物质的浓度满足c(CH4)·c(CO2)=c2(CO)·c2(H2)
C.容器内混合气体的总压强不再变化
D.容器内混合气体密度保持不变
②达到平衡时,容器Ⅰ、Ⅱ内 CO 的物质的量的关系满足:2n(CO)Ⅰ_____n(CO)Ⅱ(填“>”、“=”或“<”)
(3)将一定量的甲烷和氧气混合完成反应(i),其他条件相同,在甲、乙两种不同催化剂作用下, 相同时间内测得 CH4 转化率与温度变化关系如图所示。c 点_____(填“可能”、“一定”或“一定未”)达到平衡状态,理由是_____。

(4)CO2 也可通过催化加氢合成乙醇,其反应原理为:2CO2(g)+6H2(g)C2H5OH(g)+3H2O(g) H<0。设 m 为起始时的投料比,即 m= n(H2)/ n(CO2)。通过实验得到下列图象:
图1 图2
图2 图3
图3
①图 1 中投料比相同,温度从高到低的顺序为_________。
②图 2 中 m1、m2、m3 从大到小的顺序为_________。
③图 3 表示在总压为 5 MPa 的恒压条件下,且 m=3 时,平衡状态时各物质的物质的量分数与温度的关系。T4 温度时,该反应压强平衡常数KP的计算式为_________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,代入数据,不用计算)。
【题目】某实验室以含镍废料(主要成分为NiO,还含有少量 FeO、Fe2O3、CoO、BaO 和SiO2)为原料制备NixOy 和碳酸钴(CoCO3)的工艺流程如图:
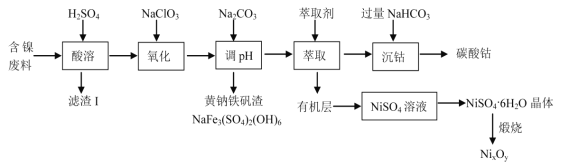
已知有关氢氧化物开始沉淀和沉淀完全的 pH 如表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Ni(OH)2 |
开始沉淀的 pH | 1.5 | 6.5 | 7.2 | 7.7 |
沉淀完全的 pH | 3.7 | 9.7 | 9.4 | 9.2 |
请回答以下问题:
(1)“滤渣Ⅰ”主要成分为(填化学式)_____。
(2)“氧化”时(加入 NaClO3)的离子方程式为_____。
(3)加入 Na2CO3 来“调 pH”的目的是生成黄钠铁钒沉淀而除去铁,也可通过加入MO(对应的金属氧化物)来调节 pH 将铁除去,则 pH 控制的范围为_____。
(4)在实验室萃取操作应该在_____中完成(填仪器名称),向水相中加入NaHCO3 时的离子方程式为_________。
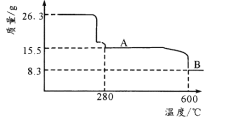
(5)从 NiSO4 溶液获得NiSO4·6H2O 晶体的操作依次是:_____,_________,过滤,洗涤,干燥。“煅烧”时剩余固体质量与温度变化曲线如图,该曲线中 B 段所表示氧化物的名称为_____。