题目内容
【题目】我国自主研发对二甲苯的绿色合成路线取得新进展,其合成示意图如下:

下列说法不正确的是
A. 过程i发生了取代反应
B. 中间产物M的结构简式为![]()
C. 利用相同原理以及相同原料,也能合成间二甲苯
D. 该合成路线理论上碳原子100%利用,且最终得到的产物易分离
【答案】A
【解析】
过程ⅰ:是异戊二烯与丙烯发生加成反应形成六元环![]() ,过程ⅱ
,过程ⅱ![]() 在催化剂作用下,生成对二甲苯与水;
在催化剂作用下,生成对二甲苯与水;
A. 过程i异戊二烯与丙烯醛发生加成反应形成六元环中间体,故选A;
B. 通过M的球棍模型可知:中间产物M的结构简式为![]() ,故不选B;
,故不选B;
C. 根据合成路线,可以合成间二甲苯和对二甲苯,不能合成邻二甲苯,故不选C;
D. 该合成路线第一步发生加成反应,第二步发生脱水反应,因此碳原子100%利用,对二甲苯不溶于水所以最终得到的产物易分离,故不选D;
答案:A

 名校课堂系列答案
名校课堂系列答案【题目】I.50 mL 1.0mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
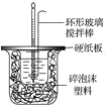
(1)___(填“能”或“不能”)将环形玻璃搅拌棒改为环形金属(如铜)棒。
(2)大烧杯上如不盖硬纸板,对求得中和热数值的影响是__(填“偏高”“偏低”或“无影响”)。
(3)如果改用60 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量__(填“增加”“减少”或“不变”);所求中和热数值__(填“增加”“减少”或“不变”)。
(4)__(填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液。
(5)Q=cmΔt,其中Q表示此中和反应放出的热量,m表示反应后混合液的质量,c表示反应后混合溶液的比热容,Δt表示反应前后溶液的温度的差值。该实验小组做了三次实验,每次取溶液各50 mL,并记录如下原始数据:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ |
1 | 25.0 | 32.6 | |
2 | 25.1 | 31.8 | |
3 | 25.1 | 31.9 |
已知盐酸、NaOH溶液密度近似为1.00 g·cm-3,中和后混合液的比热容c=4.184×10﹣3kJ·g-1·℃-1则该反应的中和热为ΔH=__(保留小数点后一位)。
(6)上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是__(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度
II. 草酸与高锰酸钾在酸性条件下能够发生反应:
现用 0.1 mol/L KMnO4酸性溶液与0.5 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。实验过程的数据记录 (见表格),请结合表中信息,回答有关问题:
实验 序号 | 反应温度/℃ | 参加反应的物质 | |||||
KMnO4(H2SO4) | H2C2O4 | H2O | MnSO4 | ||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | G | ||
A | 20 | 10 | 0.1 | 10 | 0.5 | 0 | 0 |
B | 20 | 10 | 0.1 | 6 | 0.5 | V1 | 0 |
C | 20 | 10 | 0.1 | 10 | 0.5 | 0 | 1 |
D | 50 | 10 | 0.1 | 6 | 0.5 | 0 | 0 |
E | 40 | 10 | 10 | 0.5 | 0 | 0 | |
(1)写出反应的化学方程式____________________________________;
(2)如果研究催化剂对化学反应速率的影响,使用实验________和________(用A~E表示,下同)
(3)如果研究温度对化学反应速率的影响,使用实验________和________;
【题目】对甲烷和 CO2 的高效利用不仅能缓解大气变暖,而且对日益枯竭的石油资源也有一定的补充作用,甲烷临氧耦合 CO2 重整反应有:
反应(i):2CH4(g)+O2(g)2CO(g)+4H2(g) △ H=-71.4kJmol-1
反应(ii):CH4(g)+CO2(g)2CO(g)+2H2(g) △ H=+247.0 kJmol-1
(1)写出表示 CO 燃烧热的热化学方程式:_____。
(2)在两个体积均为 2L 的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下进行反应(ii):CH4(g)+CO2(g)2CO(g)+2H2(g) (不发生其它反应),CO2的平衡转化率如表所示:
容器 | 起始物质的量(n) / mol | CO2的平衡转化率 | |||
CH4 | CO2 | CO | H2 | ||
Ⅰ | 0.1 | 0.1 | 0 | 0 | 50% |
Ⅱ | 0.1 | 0.1 | 0.2 | 0.2 | / |
①下列条件能说明反应达到平衡状态的是_____。
A.v正(CH4) =2v逆(CO)
B.容器内各物质的浓度满足c(CH4)·c(CO2)=c2(CO)·c2(H2)
C.容器内混合气体的总压强不再变化
D.容器内混合气体密度保持不变
②达到平衡时,容器Ⅰ、Ⅱ内 CO 的物质的量的关系满足:2n(CO)Ⅰ_____n(CO)Ⅱ(填“>”、“=”或“<”)
(3)将一定量的甲烷和氧气混合完成反应(i),其他条件相同,在甲、乙两种不同催化剂作用下, 相同时间内测得 CH4 转化率与温度变化关系如图所示。c 点_____(填“可能”、“一定”或“一定未”)达到平衡状态,理由是_____。

(4)CO2 也可通过催化加氢合成乙醇,其反应原理为:2CO2(g)+6H2(g)C2H5OH(g)+3H2O(g) H<0。设 m 为起始时的投料比,即 m= n(H2)/ n(CO2)。通过实验得到下列图象:
图1 图2
图2 图3
图3
①图 1 中投料比相同,温度从高到低的顺序为_________。
②图 2 中 m1、m2、m3 从大到小的顺序为_________。
③图 3 表示在总压为 5 MPa 的恒压条件下,且 m=3 时,平衡状态时各物质的物质的量分数与温度的关系。T4 温度时,该反应压强平衡常数KP的计算式为_________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,代入数据,不用计算)。










