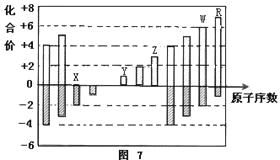
【题目】下表为元素周期表的一部分,用化学用语回答下列问题:
主族 周期 | I | II | III | IV | V | VI | VII |
一 | ① | ||||||
二 | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)⑧的原子结构示意图为________________。
(2)④和⑧在周期表中的位置分别是________________;________________。
(3)②和③气态氢化物稳定性的大小顺序:________________(填化学式)。
(4)③⑧⑩的最高价含氧酸的酸性最强的是________________(填化学式)。
(5)③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是__(填化学式),属于___(填“共价化合物”或“离子化合物”)。
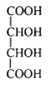
(6)①④⑩三种元素的原子能形成原子数目比为1∶1∶1的共价化合物,它的电子式为_____。
(7)欲比较④和⑨两种元素的非金属性强弱,可以作为验证的证据是_____(填字母)。
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难
C.比较这两种元素的最高价氧化物对应水化物的酸碱性
D.比较这两种元素单质与酸或碱反应的难易性
【题目】乙苯(![]() )、苯乙烯(
)、苯乙烯(![]() )均是重要的有机溶剂和工业原料。
)均是重要的有机溶剂和工业原料。
已知:①![]() (g)+HCl(g)
(g)+HCl(g)![]()
![]() (g) △H1= 54 kJmol1
(g) △H1= 54 kJmol1
②H2(g)+Cl2(g)=2HCl(g) △H2=185 kJmol1
③![]() (g)+Cl2(g)
(g)+Cl2(g)![]()
![]() (g)+HCl(g) △H3=118kJmol1
(g)+HCl(g) △H3=118kJmol1
④相关化学键的键能数据如表所示:
化学键 | CH | CC | C=C | CCl | HCl |
键能/(kJmol1) | 412 | 348 | x | 341 | 432 |
请回答:
(1)x=___;
(2)![]() (g)+H2(g)
(g)+H2(g)![]() (g) △H4
(g) △H4
①△H4=___。
②上述反应中,![]() 的平衡转化率α与温度(T)和压强(P)的关系如图所示。则:
的平衡转化率α与温度(T)和压强(P)的关系如图所示。则:
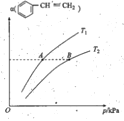
I.A、B两点的平衡常数:K(A)___K(B)(填“大于”、“小于”或“等于”)。
II.A、B两点的正反应速率:v(A)___v(B)(填“大于”、“小于”或“等于”)。
(3)工业中用乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH=CH2)。向体积为VL的恒容容器中充入amol乙苯,压强为1×106Pa,在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:
①乙苯的平衡转化率为___;
②此温度下乙苯催化脱氢的方法制取苯乙烯的平衡常数Kp=___Pa;
③实际生产的反应在常压下进行,且向乙苯蒸气中掺入水蒸气,利用热力学数据计算得到温度和投料比对乙苯转化率的影响可用图表示。[M=n(H2O)/n(乙苯]
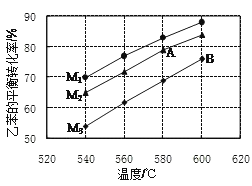
a.图中投料比(M1、M2、M3)的大小顺序为___;
b.随着反应的进行,催化剂上的少量积炭使其活性减弱,水蒸气有助于恢复催化剂的活性,原因是___(用化学方程式表示)。