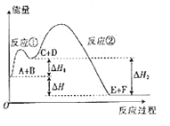
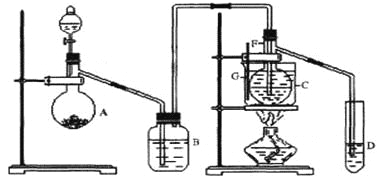
��Ŀ����
����Ŀ���װ�ѧ������ʵ�����Ʊ������ͻ�ԭ�����������ʵ���ʣ�����ʵ���ͬһ��Һ����Ұ������ȤС��ͬѧ��������ͼ��ʾ��̽������ش�
(1)����ٵIJ���������___________�����õ��IJ���������©������������___________��
(2)�ɲ����ʵ��������֪���װ�ͬѧ��ȡ�������õĹ��巴Ӧ����___________��д��ѧʽ����
(3)�ɲ����������Һ�����������ƿɵú���ɫ�������÷�Ӧ�Ļ�ѧ����ʽΪ______________________��
(4)�ɲ���۲����������жϹ���A��һ������___________��д���ƣ����ۺϲ���ۢ���������������A�л����ܺ��е�������______________________��д�����������ʵĻ�ѧʽ����
(5)��������ʵ��ͷ����жϹ���C��___________��д��ѧʽ����
���𰸡����� �ձ� KClO3 Fe2(SO4)3+6NaOH=2Fe(OH)3![]() +3Na2SO4 ̿ MnO2 ��Fe ��Fe2O3 MnO2
+3Na2SO4 ̿ MnO2 ��Fe ��Fe2O3 MnO2
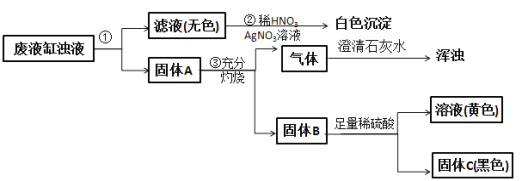
��������
��������ٵIJ������Ϊ�������Һ�������Ϊ���ˣ���Һ����ϡ�������������Һ����������ƶ���Һ�к��������ӣ�����A���ղ�����������ʹ����ʯ��ˮ����ǣ���֪����Ϊ������̼�������A�к�̼��
(1)���Ϸ����������Ϊ���˲��������õIJ���������©�������������ձ���
(2)����ڲ�����ɫ������˵����Һ�к��������ӣ���װ�ͬѧ���ü�������غͶ������̻����ķ�����ȡ������ͬʱ��Ӧ�����Ȼ��ء�
(3)��������û�ɫ��Һ�����������ƿɵú���ɫ�����������Ϊ������������ɫ��ҺΪ����������Ӧ����ʽΪFe2(SO4)3+6NaOH=2Fe(OH)3![]() +3Na2SO4��
+3Na2SO4��
(4)���Ϸ���������A��һ������̼���ۺϲ���ۢ���������������A�л����ܺ�����ȡ����ʹ�õĶ������̡���ԭ����������ʱʣ���Fe2O3��������Fe��
(5)�������������жϹ���CΪ����طֽ�Ĵ����������̣���ѧʽΪMnO2��

����Ŀ��X��Y��Z��W��Ԫ�����ڱ�ǰ�������е����ֳ���Ԫ�أ��������Ϣ���±���
Ԫ�� | �����Ϣ |
X | X�ļ۵����Ų�ʽΪnsnnpn |
Y | Y�ĸ�һ�����ӵĵ��Ӳ�ṹ�������ͬ |
Z | ���³�ѹ�£�Z�����ǵ���ɫ���壬���ڻ�ɽ�ڸ������� |
W | Wԭ�ӹ���6���۵��ӣ���������۵���λ�ڵ����ܲ�d��� |
(1)Z��Ԫ�����ڱ��е�λ�� _______________________��Z���⻯��ռ乹����________
(2)��H��Y��H��Z���ֹ��ۼ��У����ļ��Խ�ǿ����____________(����Ӧ��Ԫ�ط��ű�ʾ�ù��ۼ�)��
(3)XZ2������X��________��ʽ�ӻ���
(4)д��WԪ�ص�ԭ�Ӻ�������Ų�ʽ___________________________________��
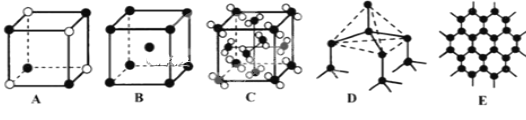
(5)YԪ�غ�Na�γɾ���IJ��ֽṹ������ͼ�е�_________����ʾ(�����)��
����Ŀ���װ�(CH3NH2)�Ǻϳ�̫������������ԭ�ϡ�һ���¶��£������������Ϊ2.0 L�ĺ����ܱ������а���ͬ��ʽͶ�뷴Ӧ�������ӦCH3OH(g)��NH3(g) CH3NH2(g)��H2O(g)������й�ʵ���������£�
������� | �¶�/K | ��ʼ���ʵ�����mol�� | ƽ�����ʵ���mol | ||||
CH3OH | NH3 | CH3NH2 | H2O | CH3NH2 | H2O | ||
I | 530 | 0.40 | 0.40 | 0 | 0 | 0.30 | |
II | 530 | 0.80 | 0.80 | 0 | 0 | ||
III | 500 | 0 | 0 | 0.20 | 0.20 | 0.16 | |
����˵����ȷ����(����)
A. ����Ӧ��ƽ�ⳣ��K(��)��K(��)<K(��)
B. �ﵽƽ��ʱ����ϵ��c(CH3OH)��ϵ��2c(CH3OH����)>c(CH3OH����)
D. 530Kʱ������ʼ���������г���CH3OH 0.10 mol��NH3 0.15 mol��CH3NH2 0.10 mol��H2O 0.10 mol����Ӧ�����淴Ӧ�������
����Ŀ����25��ʱ���������ʵĵ���ƽ�ⳣ�������ʾ��
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | 1.7��10-5 | K1��4.3��10-7 K2��5.6��10-11` | 3.0��10-8 |
��ش��������⣺
��1��д��̼��ĵ�һ�����뷽��ʽ��________��
��2�����ʵ���Ũ����ͬ��������Һ��a.CH3COONa b��NaHCO3 c��NaClO
������Һ��pH��С�������е�˳����___<___< ___(�ñ����д)
��3��д����NaClO��Һ��ͨ������CO2�Ļ�ѧ����ʽ________��
��.��4��̼������Һ�ʼ��Ե�ԭ���ǣ�______����д�����ӷ���ʽ����0.01mol/L Na2CO3��Һ��pH____0.1mol/LNa2CO3��Һ��pH������������������������==����
��5��Ũ�Ⱦ�Ϊ0.1mol/L�Ģ�CH3COONa��Һ��NH4Cl��Һ��ϡHCl��Na2SO4��Һ��pH�ɴ�С������˳��Ϊ____
��6������ˮFeCl3���Լ�ƿ����ð����������������������Ӧ�Ļ�ѧ����ʽΪ________