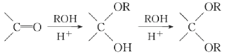
【题目】(1)某学生为了探究锌与盐酸反应过程中的速率变化,在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 50 | 120 | 232 | 290 | 310 |
①上述实验过程中,反应速率最大时间段是________(选填字母作答),该时间段反应速率最大的主要原因是________________________________________________________。
A.0~1min B.1~2min C.2~3min D.3~4min E.4~5min
②求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率___________________(假设反应过程中溶液体积不变)。
(2)某温度下在容积为1L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。

①该反应的化学方程式是______________________________________________。
②该反应达到平衡状态的标志是________。
A.X的浓度不再改变
B.Y的体积分数在混合气体中保持不变
C.容器内气体的总压强保持不变
D.容器内气体的总质量保持不变
③反应进行到2min时,Y的转化率为_____________。
(3)燃料电池可以将气体燃料和氧气直接反应产生电能,其效率高、污染低,是一种很有前途的能源利用方式。但传统燃料电池使用氢气为燃料,而氢气既不易制取又难以储存,导致燃料电池成本居高不下。科研人员尝试用便宜的甲烷、乙烷等碳氢化合物为燃料,设计出新型燃料电池,使其成本大大低于以氢气为燃料的传统燃料电池。请写出以甲烷为燃料、硫酸为电解质溶液的该新型燃料电池工作时负极的电极反应方程式_________。
【题目】随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点。完成下列填空:
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g),已知H2的体积分数随温度的升高而增加.若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
CH4(g)+2H2O(g),已知H2的体积分数随温度的升高而增加.若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
v正 | v逆 | 平衡常数K | 转化率α |
________ | ________ | ________ | ________ |
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
[CO2]/molL﹣1 | [H2]/molL﹣1 | [CH4]/molL﹣1 | [H2O]/molL﹣1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为________.
(3)碳酸:H2CO3 , K1=4.3×10﹣7 , K2=5.6×10﹣11 草酸:H2C2O4 , K1=5.9×10﹣2 , K2=6.4×10﹣5 ,0.1mol/LNa2CO3溶液的pH____0.1mol/LNa2C2O4溶液的pH,(选填“大于”“小于”或“等于”),等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是___.
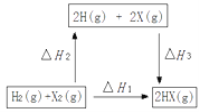
(4)在如图的转化关系中(X代表卤素)。ΔH2_____0(填“>”、“=”或“<”);△H1、△H2和△H3三者存在的关系为_______。
(5)现有浓度均为0.1mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④醋酸钠。请回答下列问题:
①醋酸钠中各离子浓度由大到小的顺序是_______。
②醋酸和醋酸钠等体积混合所得溶液中:c(CH3COOH)+c(CH3COO-)=______mol·L-1。