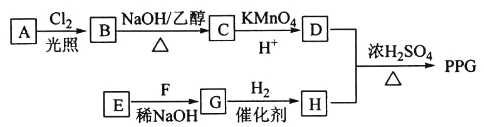
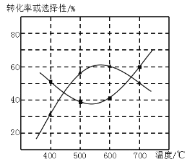
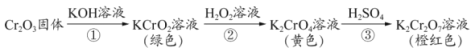
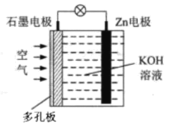
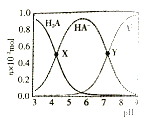
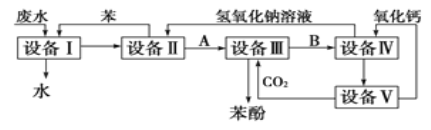
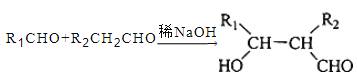0 196211 196219 196225 196229 196235 196237 196241 196247 196249 196255 196261 196265 196267 196271 196277 196279 196285 196289 196291 196295 196297 196301 196303 196305 196306 196307 196309 196310 196311 196313 196315 196319 196321 196325 196327 196331 196337 196339 196345 196349 196351 196355 196361 196367 196369 196375 196379 196381 196387 196391 196397 196405 203614