【题目】氮是化肥工业和化工生产的主要原料,工业上合成氨使用的氢气主要来自合成气(CO、H2混合气体)。请回答下列问题:
(1)工业上合成氨的反应原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH 。 已知:
2NH3(g) ΔH 。 已知:
化学键 | H-H | N≡N | N-H |
键能/kJ·mol-1 | 436 | 945.6 | 391 |
化学键的键能是形成或断裂1 mol 化学键放出或吸收的能量,单位为kJ/mol。上述反应的ΔH________________。
(2)联氨(又称肼,N2H4),试写出联氨的电子式_________;联氨又可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH1
N2H4(l)+O2(g)= N2(g)+2H2O(g) ΔH2
则N2(g)+2O2(g)=N2O4 (l) ΔH3=_________
(3)以氨气代替氢气来研发氨燃料电池是当前科研的一个热点。氨燃料电池使用的电解质溶液是KOH溶液,其装置如图所示。a电极反应式为________。若该燃料电池消耗标准状况下6.72 L空气(假设空气中O2体积分数为20%),则理论上消耗NH3的质量为_______g。

(4)甲醇燃料电池在生活应用也很广泛,在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。写出该电池的负极反应式______________。
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
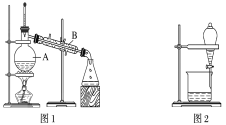
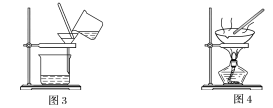
(1)装置图1中B的名称是________________,图2中漏斗的名称是________________。A中一般要加入碎瓷片,其作用是__________________________。下列关于以上实验操作说法一定正确的是_。
A.图1实验中,加热一段时间后发现未加入碎瓷片,应马上添加,以防发生危险
B.图2实验中,应打开活塞,将有机溶剂从下端导管中放出
C.图3实验中,可以用玻璃棒在漏斗中搅拌,以加快过滤速度
D.图4实验中,当加热至有较多固体析出时,即停止加热
(2)现有一瓶A和B的混合液,已知它们的性质如下表。
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水和酒精 |
B | 17.9 | 290 | 1.26 |
据此分析,将A和B相互分离可选用上图中的图________________所示仪器。
(3)在图2所示实验中,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。____。




