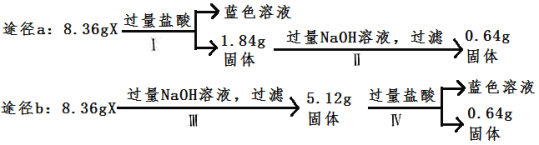
【题目】氯气在工农业生产在应用非常广泛。下图是实验室制备氯气并进行一系列相关实验的装置。
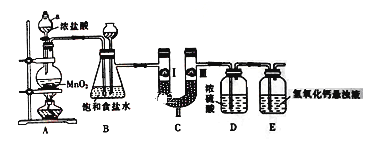
(1) 仪器a的名称为_______________。
(2) 装置B中饱和食盐水的作用是_________________;
(3) 写出A装置中发生反应的化学方程式______________________
(4) 装置C的作用是验证氯气是否具有漂白性,为此装置C中I、II、III处依次放入__________(填字母)。
选项 | a | b | c |
I | 湿润的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 浓硫酸 | 无水氯化钙 |
III | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(5) 装置E中氢氧化钙悬浊液的作用是___________________,同时该装置工业上可用来制取漂白粉,请写出相应反应的化学方程式:___________________。
【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%,质量分数),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO47H2O的工艺流程如下:
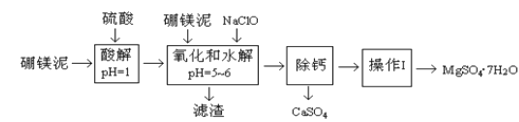
(1)实验中需要1 mol/L的硫酸980 mL,若用 98% 的浓硫酸(ρ= 1.84 g/mL)来配制,量取浓硫酸需要使用量筒的规格为____(填写选项字母)。
A.10 mL B.20 mL C.50 mL D.100 mL
(2)加入的NaClO可与Mn2+ 反应:Mn2+ + ClO + H2O = MnO2↓+ 2H+ + Cl ,在该步骤中还有一种离子也会被NaClO氧化,该反应的离子方程式为________。
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有______,____。
(4)在“除钙”前,需检验滤液中Fe3+ 是否被除尽,简述检验方法_____。(写出操作、现象和结论)
(5)已知MgSO4、CaSO4 的溶解度(单位为 g/100 g 水)如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤_______。“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,______,便得到了MgSO47H2O。
(6)实验中提供的硼镁泥共100 g ,得到 MgSO47H2O 为196.8 g ,则MgSO47H2O 的产率为____。