题目内容
【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%,质量分数),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO47H2O的工艺流程如下:
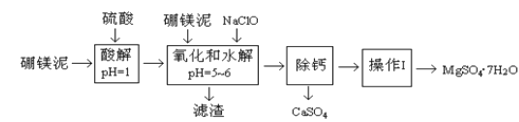
(1)实验中需要1 mol/L的硫酸980 mL,若用 98% 的浓硫酸(ρ= 1.84 g/mL)来配制,量取浓硫酸需要使用量筒的规格为____(填写选项字母)。
A.10 mL B.20 mL C.50 mL D.100 mL
(2)加入的NaClO可与Mn2+ 反应:Mn2+ + ClO + H2O = MnO2↓+ 2H+ + Cl ,在该步骤中还有一种离子也会被NaClO氧化,该反应的离子方程式为________。
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有______,____。
(4)在“除钙”前,需检验滤液中Fe3+ 是否被除尽,简述检验方法_____。(写出操作、现象和结论)
(5)已知MgSO4、CaSO4 的溶解度(单位为 g/100 g 水)如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤_______。“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,______,便得到了MgSO47H2O。
(6)实验中提供的硼镁泥共100 g ,得到 MgSO47H2O 为196.8 g ,则MgSO47H2O 的产率为____。
【答案】D 2Fe2++ClO+2H+═2Fe3++Cl+H2O MnO2 SiO2 取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+ 蒸发浓缩(结晶)、趁热过滤 再经过过滤 80%
【解析】
硼镁泥主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,加入硫酸,MgO、CaO、MnO、Fe2O3、FeO、Al2O3都和硫酸反应,SiO2不与硫酸反应,次氯酸钠具有强氧化性,加入的NaClO可与Mn2+反应生成MnO2,把亚铁离子氧化成铁离子,溶液pH升高,铁离子生成氢氧化铁沉淀,铝离子形成氢氧化铝沉淀,过滤除去滤渣Fe(OH)3、Al(OH)3、MnO2、SiO2,滤液中含钙离子、镁离子,除钙后,只剩镁离子,蒸发冷却结晶得到硫酸镁晶体。
(1)需用1mol/L的硫酸980mL,应配制1000mL溶液,若用98%的浓硫酸(ρ=1.84g/mL)来配制,结合溶液配制前后溶质的物质的量不变可知,量取浓硫酸为 =0.054L=54mL,则选择量筒为100mL;
=0.054L=54mL,则选择量筒为100mL;
故答案为:D;
(2)NaClO溶液在加热条件下将溶液中的Mn2+氧化成MnO2,反应的离子方程式为Mn2++ClO+H2O=MnO2↓+2H++Cl,溶液中含有Fe2+,具有还原性,可与NaClO发生氧化还原反应,反应的离子方程式为2Fe2++ClO+2H+=2Fe3++Cl+H2O,
故答案为:2Fe2++ClO+2H+═2Fe3++Cl+H2O;
(3)SiO2不与硫酸反应,次氯酸钠具有强氧化性,加入的NaClO可与Mn2+反应生成MnO2,把亚铁离子氧化成铁离子,溶液PH升高,铁离子生成氢氧化铁沉淀,铝离子形成氢氧化铝沉淀,过滤得滤渣Fe(OH)3、Al(OH)3、MnO2、SiO2,
故答案为:MnO2、SiO2;
(4)检验滤液中Fe3+是否被除尽,检验方法为取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+,
故答案为:取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+;
(5)由温度对硫酸镁、硫酸钙的溶解度影响,温度越高,硫酸钙溶解度越小,可以采用蒸发浓缩,趁热过滤方法除去硫酸钙;操作I是将滤液继续蒸发浓缩,冷却结晶,再经过过滤,便得到MgSO47H2O晶体;
故答案为:蒸发浓缩(结晶)、趁热过滤;再经过过滤;
(6)硼镁泥主要成份是MgO(占40%),则100g中含Mg为100g×40%×![]() ×100%=24g,由Mg原子守恒可知得到MgSO47H2O为
×100%=24g,由Mg原子守恒可知得到MgSO47H2O为![]() ×246g/mol=246g,则MgSO47H2O的产率为
×246g/mol=246g,则MgSO47H2O的产率为![]() ×100%=80%,
×100%=80%,
故答案为:80%。

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】A、B、C、D, E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
A | 原子核外有6种不同运动状态的电子 |
C | 基态原子中s电子总数与p电子总数相等 |
D | 原子半径在同周期元素中最大 |
E | 基态原子最外层电子排布式为3s23p1 |
F | 基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反 |
G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
H | 是我国使用最早的合金中的最主要元素 |
请用化学用语填空:
(1)A元素位于元素周期表第_______周期_______族;B元素和C元素的第一电离能比较,较大的是________,C元素和F元素的电负性比较,较小的是________。
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的分子模型为________,B元素所形成的单质分子![]() 键与π键数目之比为________。
键与π键数目之比为________。
(3)G元素的低价阳离子的离子结构示意图是________,F元素原子的价电子的轨道表示式是________,H元素的基态原子核外电子排布式的________。
(4)G的高价阳离子的溶液与H单质反应的离子方程式为_________________;与E元素成对角线关系的某元素的最高价氧化物的水化物具有两性,写出该两性物质与D元素的最高价氧化物的水化物反应的离子方程式:_________________。