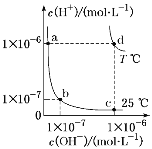【题目】(1)已知Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=2.6×10-39。常温下,某酸性CuCl2溶液中含有少量的FeCl3,为了得到纯净的CuCl2·2H2O晶体,应加入___________(填氧化物的化学式),调节溶液的pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。水垢需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗涤液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
①用稀盐酸溶解碳酸钙的离子方程式是_____________________________。
②已知:25 ℃时有关物质的溶度积
物质 | CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
Ksp | 2.8×10-9 | 9.1×10-6 | 1.8×10-11 | 6.8×10-6 |
根据数据,结合化学平衡原理解释清洗CaSO4的过程________________。(用溶解平衡表达式和必要的文字叙述加以说明);在步骤Ⅰ浸泡过程中还会发生反应MgCO3(s)+2OH-(aq)![]() Mg(OH)2(s)+CO32-(aq),该反应的平衡常数K=________(保留两位有效数字)。
Mg(OH)2(s)+CO32-(aq),该反应的平衡常数K=________(保留两位有效数字)。
③步骤Ⅲ中,加入Na2SO3溶液的目的是_______________________________。
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气。(实验记录的体积为累计值,已换算成标准状况):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大___,原因是___。
(2)哪一段时段的反应速率最小___,原因是___。
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)___。
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:
A.蒸馏水 B.NaCl溶液 C.NaNO3溶液D.Na2CO3溶液
你认为可行的是(填编号)___。
【题目】由A、B、C、D四种金属按下表中装置进行实验,根据实验现象填表:
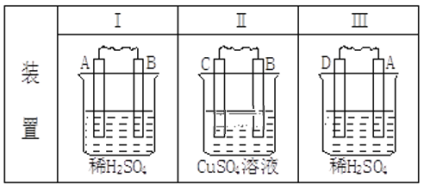
现象 | (I)金属A逐渐溶解 | (Ⅱ)C的质量增加 | (Ⅲ)A上有气体产生 |
填正极反应式 | ___ | ___ | |
四种金属活动性由强到弱的顺序:___。 | |||
若装置(Ⅲ)中A极产生的气体在标准状况下的体积为224mL,则通过导线中的电子的物质的量为___mol。 | |||
【题目】下表为元素周期表的一部分,根据表中序号对应元素回答有关问题:
族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ | ⑩ |
(1)表中元素,化学性质最不活泼的是___,只有负价而无正价的是___,原子半径最大的是___;(填写元素符号);
(2)表中能形成两性氢氧化物的元素是___(填元素符号),分别写出该元素的氢氧化物与⑥、⑨的最高价氧化物对应水化物反应的离子方程式分别是___、___。
(3)元素①组成的单质的电子式为___;用电子式表示⑥的氢化物的形成过程___。
(4)②和③的单质加热时反应生成物质X,其化学式为___,该物质中含有的化学键的类型为___。