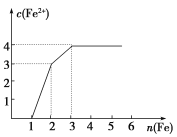
【题目】A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
阳离子 | Na+、K+、Cu2+ |
阴离子 | SO42-、OH- |
如图1所示装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图2所示。请回答下列问题:
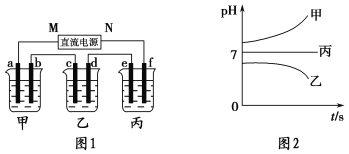
(1)M为直流电源的________极,b电极上发生的电极反应为______________________。
(2)计算e电极上生成的气体在标准状况下的体积为________________。
(3)写出乙烧杯中的总反应方程式:____________________________________________。
【题目】用图表来处理数据是发现科学规律的一种重要方法。
(1)下图是原子序数为1~18的元素原子的最外层电子数随原子序数变化的直方图。图中元素a 是__,b 是____。

(2)下图表示元素的一种性质随原子序数变化的情况,根据分析,该图纵坐标表示的是_________。

(3)下表给出了部分元素的原子半径。
元素符号 | Li | Be | B | C | N | O | F | Na | K | Rb | Cs |
原子半径/nm | 0.152 | 0.089 | 0.082 | 0.077 | 0.075 | 0.074 | 0.071 | 0.186 | 0.227 | 0.248 | 0.265 |
请根据表中数据分析同周期元素原子半径的递变规律是______,同主族元素原子半径的递变规律是_____根据表中得出的规律比较Ca2+和Cl-的半径大小:r(Ca2+)_____r(Cl-)(填“>”“<”或“=”)。
【题目】工业上利用H2合成氢的反应原理为:3H2(g)+N2(g) ![]() 2NH3(g)。现有甲、乙两个容积为1L的密闭容器.在相同条件下,按不同的反应物投入量进行合成氢反应相关数据如下表示:
2NH3(g)。现有甲、乙两个容积为1L的密闭容器.在相同条件下,按不同的反应物投入量进行合成氢反应相关数据如下表示:
容器 | 甲 | 乙 |
反应物投入量 | 2molH2、2molN2 | 4malH2.4molN2 |
平衡时N2的浓度(mol/L) | c1=1.5 | c2 |
NH3的体积分数 | ω1 | ω2 |
混合气体的密度(g/L) | ρ1 | ρ2 |
(1)下列情况下,反应达到平衡状态的是_____(填序号)
A、3molH-H共价键断裂同时有6molN-H共价键形成
B、3v正(N2)=v逆(H2)
C、混合气体的平均相对分子质量保持不变
(2)反应的平衡常数K=_____________________(结果保留3位有效数字).
(3)分析上表中的数据,有以下关系:c2________3mol/L;ω1________ω2(填“>”、“<”、“=”);
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为___________(写离子符号);若所得溶液c(HCO3)∶c(CO32)=2∶1,溶液pH=___________。(室温下,H2CO3的K1=4×107;K2=5×1011)
(2)CO2与CH4经催化重整,制得合成气:CH4(g)+ CO2(g) ![]() 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)
已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=______。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是____(填“A” 或“B ”)。