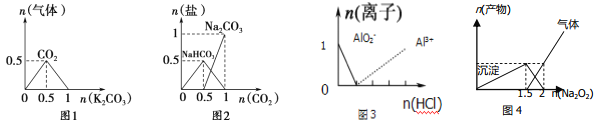题目内容
【题目】有A、B、C、D 四种短周期元素,A 与B 可形成离子化合物BA,BA 中阴阳离子的核外电子排布相同;B 原子最外层只有-个电子;C 元素有三种不同的核素C1、C2、C3,且三种核素的质量数之比为1:2:3;D 原子的质子数是A、B、C 三种原子质子数之和的![]() 。
。
回答下列问题:
(1)写出各元素的元素符号:A____,B____,C____,D____。
(2)写出C1、C2、C3三种核素的原子符号:C1____,C2_____,C3______。
(3)C、D 两种元素形成的微粒X 与化合物BA 中的阳离子所含的质子数和电子数分别相等,则X 的化学式是________。
【答案】F Na H N ![]()
![]()
![]() NH4+
NH4+
【解析】
B原子最外层只有一个电子,则B为IA族元素,BA中阴阳离子的核外电子排布相同,则A与B为邻周期,B为ⅦA族;C元素有三种不同的核素C1、C2、C3,且三种核素的质量数之比为1:2:3,则C为H,质子数为1 ;则A处于第二周期,B处于第三周期,分别为:F、Na,质子数分别为:9、11,则D的质子数是![]() =7,故D为N,据此分析解答。
=7,故D为N,据此分析解答。
(1)根据分析,A为F,B为Na,C为H,D为N;
(2)根据分析,C为H,质子数为1,三种核素质量数分别为:1、2、3。故三种核素的原子符号:![]() 、
、![]() 、
、![]() ;
;
(3)根据分析,C、D两种元素分别为:H、N,化合物BA为NaF,其中阳离子为Na+,其所含质子数为11,所含电子数为10,则X为H、N元素组成,含10电子的微粒,化学式为NH4+。

【题目】工业上利用H2合成氢的反应原理为:3H2(g)+N2(g) ![]() 2NH3(g)。现有甲、乙两个容积为1L的密闭容器.在相同条件下,按不同的反应物投入量进行合成氢反应相关数据如下表示:
2NH3(g)。现有甲、乙两个容积为1L的密闭容器.在相同条件下,按不同的反应物投入量进行合成氢反应相关数据如下表示:
容器 | 甲 | 乙 |
反应物投入量 | 2molH2、2molN2 | 4malH2.4molN2 |
平衡时N2的浓度(mol/L) | c1=1.5 | c2 |
NH3的体积分数 | ω1 | ω2 |
混合气体的密度(g/L) | ρ1 | ρ2 |
(1)下列情况下,反应达到平衡状态的是_____(填序号)
A、3molH-H共价键断裂同时有6molN-H共价键形成
B、3v正(N2)=v逆(H2)
C、混合气体的平均相对分子质量保持不变
(2)反应的平衡常数K=_____________________(结果保留3位有效数字).
(3)分析上表中的数据,有以下关系:c2________3mol/L;ω1________ω2(填“>”、“<”、“=”);
【题目】(一)某实验小组利用如下装置(部分固定装置略)进行氮气与钙的反应,并探究其产物的性质及化学式。请回答下列问题。

(1)反应过程中末端导管必须插入试管C的水中,目的是____。(填字母)
A.吸收反应中剩余的氮气
B.控制通入气体的流速
C.防止空气中的氧气倒流进入反应装置,干扰反应
(2)该小组同学认为根据相应的质量关系可以求出生成物的化学式,数据记录如下:
A的质量m0/g | A与钙的质量m1/g | A与产物的质量m2/g |
14.80 | 15.08 | 15.15 |
①通过计算得到化学式CaxN2,其中x=____。
②小组同学查阅资料得知产物为Ca3N2,能与水强烈反应,请写出Ca3N2与水反应的化学方程式_____。
(二)铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2![]() 6SO2+Fe3O4,若有3molFeS2参加反应,转移电子的物质的量为_____。
6SO2+Fe3O4,若有3molFeS2参加反应,转移电子的物质的量为_____。
(2)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为____。
(3)将一定量的Fe2O3溶于160mL 5molL-1盐酸中,再加入一定量铁粉,铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为____。