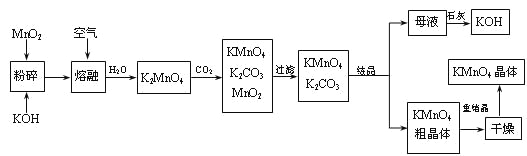
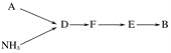【题目】POC13常用作半导体掺杂剂及光导纤维原料,实验室制备POC13并测定产品含量的实验过程如下:
I.实验室制备POC13。采用氧气氧化液态PCl3法制取POC13,实验装置(加热及夹持仪器略)如下图:
资料:①Ag++SCN-=AgSCN↓ Ksp(AgCl)>Ksp(AgSCN);

②PCl3和POC13的相关信息如下表:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
POC13 | 2.0 | 106.0 | 153.5 |
(1)仪器a的名称____________________。
(2)B中所盛的试剂是________,干燥管的作用是_____________________。
(3)POC13遇水反应的化学方程式为____________________________。
(4)反应温度要控制在60~65℃,原因是:____________________________。
II.测定POC13产品的含量。实验步骤:
①制备POC13实验结束后,待三颈瓶中的液体冷却至室温,准确称取29.1g产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00 mL溶液。
②取10.00 mL溶液于锥形瓶中,加入20.00 mL 3.5mol/L AgNO3标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X为指示剂,用1.00mol/LKSCN溶液滴定过量AgNO3溶液,达到滴定终点时共用去10.00mLKSCN溶液。
(5)步骤④中X可以选择___________________ 。
(6)步骤③若不加入硝基苯,会导致测量结果______(填偏高,偏低,或无影响)
(7)反应产物中POC13的质量百分含量为___________________, 若滴定终点,读取KSCN溶液俯视刻度线,则上述结果____________(填偏高,偏低,或无影响)
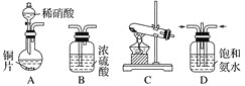
【题目】根据下列实验现象所得出的结论不正确的是
选项 | 实验现象 | 实验结论 |
A | 将铝片分别投入浓、稀硝酸中, 前者无明显现象,后者反应剧烈 | 稀硝酸的氧化性比浓硝酸的强 |
B | 向滴有酚酞的Na2CO3溶液中 加入BaCl2溶液,红色变浅 | Na2CO3溶液中存在水解平衡 |
C | 某溶液中滴加过量氨水产生 白色沉淀且不溶解 | 该溶液中可能含有Mg2+ |
D | 溴水中通入SO2,溴水褪色 | SO2具有还原性 |
A. AB. BC. CD. D
【题目】(2016·天津卷) 下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为__________。
(2)表中元素原子半径最大的是(写元素符号)__________。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1 mol Y单质比1 mol S得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1 mol X的最高价化合物,恢复至室温,放热687 kJ,已知该化合物的熔、沸点分别为69 ℃和58 ℃,写出该反应的热化学方程式:__________。
(5)碳与镁形成的1 mol化合物Q与水反应,生成2 mol Mg(OH)2和1 mol烃,该烃分子中碳氢质量比为9∶1,烃的电子式为__________。Q与水反应的化学方程式为__________。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1 L 2.2 mol/L NaOH溶液和1 mol O2,则两种气体的分子式及物质的量分别为__________,生成硫酸铜物质的量为__________。
【题目】四种短周期元素A、B、C、D的性质或结构信息如下:
信息:①原子半径:A<B<C<D。②四种元素之间形成的某三种分子的比例模型及部分性质如下:
物质 | 比例模型图 | 存在或性质 |
甲 |
| 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二 |
乙 |
| 无色,无气味并且易燃。是常见的一种基础能源 |
丙 |
| 有强氧化性的弱酸,有漂白性,可用于消毒杀菌 |
请根据上述信息回答下列问题。
(1)A的元素符号是___;C元素在元素周期表中的位置是___;甲的电子式是___。
(2)丙可由D元素的单质与物质甲反应得到,该反应的离子方程式是___;D所在周期中,E元素的单质还原性最强,则E的单质与甲反应后的溶液呈___(填“酸”或“碱”)性,用电离方程式表示其原因是___。
(3)①A、B、C元素可组成多种化合物。由A、C组成的一种化合物丁,其产量常常用来衡量一个国家石油化工发展水平,则实验室中可用来除去乙中少量丁的试是___。
②A、C组成的化合物中,化学式为C2A6,该物质与D的单质发生反应的类型___,写出其中一个化学方程式是___。
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)图中表示NO2的变化的曲线是___(填字母);
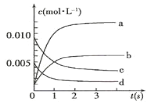
(2)800℃,反应达到平衡时,NO的转化率是___ ;
(3)用O2表示从0~2s内该反应的平均速率v=___。