【题目】二甲醚(CH3OCH3)是一种新型能源。
已知:①CO(g)+2H2(g)![]() CH3OH(g) △H1=﹣99kJ·mol-1
CH3OH(g) △H1=﹣99kJ·mol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=﹣24kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=﹣24kJ·mol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3=﹣41kJ·mol-1
CO2(g)+H2(g) △H3=﹣41kJ·mol-1
回答下列问题:
(1)写出CO和H2反应生成CO2和CH3OCH3(g)的热化学方程式_____。
(2)下列既能提高反应①中 CO 的平衡转化率,又能增大反应速率的是____(填标号)。
a.增大压强 b.降低温度 c.增大H2浓度 d.加高效催化剂
(3)在某恒温恒容容器中发生反应③,能说明该反应达到平衡的是___(填标号)。
a.气体平均相对分子质量保持不变
b.△H3保持不变
c.![]() 保持不变
保持不变
d.气体密度保持不变
(4)在一定温度(T℃)下,向恒容密闭容器中通入一定量CH3OH气体,只发生反应②。气体混合物中CH3OCH3 的物质的量分数[φ(CH3OCH3)]与反应时间(t)有关数据如表所示。
t/min | 0 | 15 | 30 | 45 | 80 | 100 |
φ(CH3OCH3) | 0 | 0.05 | 0.08 | 0.09 | 0.10 | 0.10 |
①该温度下,上述反应的平衡常数K为___(用分数表示)。
②反应速率v=v正﹣v逆,其中v正=k正·φ2(CH3OH)、v逆=k逆·φ(CH3OCH3)·φ(H2O),k正、k 逆分别为正、逆反应速率常数,![]() 只与温度有关。15min时,=___(结果保留2位小数)。
只与温度有关。15min时,=___(结果保留2位小数)。
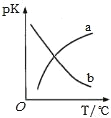
(5)在密闭容器中发生反应③,平衡常数为K。pK(pK=﹣lgK)与温度的关系如图所示,图中曲线___(填“a”或“b”)能反映平衡常数变化趋势。
【题目】下表为元素周期表的一部分,根据表中所列出的元素回答下列问题。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
2 | a | b | c | d | |||
3 | e | f | g | h | i | j |
(1)f和d形成的物质的化学式为____。
(2)ac2分子的电子式为___。
(3)g单质溶于NaOH溶液的离子方程式为____。
(4)e单质在氧气中点燃得到淡黄色固体
①淡黄色固体的电子式为___,
②该物质存在的化学键的类型有___。
(5)为了比较该部分周素表中非金属元素的非金属性强弱,以下说法不正确的是___。
a.可以利用这些元素的最高价氧化物对应水化物的酸性比较这些元素的非金属性
b.已知j的气态氢化物水溶液的酸性比i的气态氢化物的水溶液酸性强,则非金属j>i
c.向i的气态氢化物的水溶液中加j单质,发现溶液变浑浊,则i的非金属性弱于j