题目内容
【题目】按要求回答下列问题:
Ⅰ.(1)在200℃、101kPa时,0.5molH2(g)与足量I2(g)完全反应放出7.45kJ的热量,该反应的热化学方程式表示为________________________。
(2)已知:①2CH3OH(l)+3O2(g) =2CO2(g)+4H2O(g) ΔH1=-a kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-b kJ/mol
③2H2(g) + O2(g) = 2H2O(g) ΔH3 = -c kJ/mol
a、b、c均大于0 则:反应①中,ΔS______(选填“>”、“<”或“=”)0;2C(s)+4H2(g)+O2(g) = 2CH3OH(l) ΔH=_______kJ/mol。
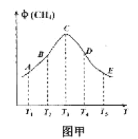
Ⅱ.已知水的电离平衡曲线如图所示,试回答下列问题:
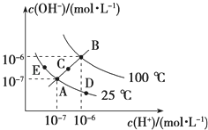
(3)图中五点KW间的关系是__________________.
(4)若从A点到D点,可采用的措施是________.
a.升温 b.加入少量的NaOH c.加入少量的NH4Cl
(5)E对应的温度下,在pH=9的NaOH溶液与pH=4的H2SO4 溶液中,水电离出的H+浓度之比为:________,若将两溶液混合所得溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为________.
【答案】H2(g) + I2(g) ![]() 2HI(g) △H=-14.9kJ/mol > a-2b-2c B>C>A=D=E c 10:1 10:1
2HI(g) △H=-14.9kJ/mol > a-2b-2c B>C>A=D=E c 10:1 10:1
【解析】
(1)利用0.5molH2(g)与足量I2(g)完全反应放出7.45kJ的热量,来计算放出的热量,根据反应热书写热化学方程式;
(2)化学反应气体体积增加,则熵增大;根据盖斯定律计算反应热;
(3)KW只与温度有关,温度升高KW变大;
(4)由图可知,A点和D点温度相同,A点为中性,D点为酸性,以此分析;
(5)E对应的温度下为常温,KW=1![]() 10-14,酸和碱都抑制水的电离,NaOH溶液中由水电离出的H+等于溶液中的H+,H2SO4 溶液中由水电离出的H+浓度等于溶液中的OH-,若将两溶液混合所得溶液的pH=7,则NaOH溶液与H2SO4溶液恰好完全反应,据此分析。
10-14,酸和碱都抑制水的电离,NaOH溶液中由水电离出的H+等于溶液中的H+,H2SO4 溶液中由水电离出的H+浓度等于溶液中的OH-,若将两溶液混合所得溶液的pH=7,则NaOH溶液与H2SO4溶液恰好完全反应,据此分析。
(1)0.5molH2(g)与足量I2(g)完全反应放出7.45kJ的热量,则1molH2(g)与足量I2(g)完全反应放出14.9kJ的热量,热化学方程式为:H2(g) + I2(g) ![]() 2HI(g) △H=-14.9kJ/mol,
2HI(g) △H=-14.9kJ/mol,
因此,本题正确答案为:H2(g) + I2(g) ![]() 2HI(g) △H=-14.9kJ/mol;
2HI(g) △H=-14.9kJ/mol;
(2)反应①2CH3OH(l)+3O2(g) =2CO2(g)+4H2O(g)是气体分子数增加的反应,故ΔS>0;
已知:①2CH3OH(l)+3O2(g) =2CO2(g)+4H2O(g) ΔH1=-a kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-b kJ/mol
③2H2(g) + O2(g) = 2H2O(g) ΔH3 = -c kJ/mol
②![]() 2+③
2+③![]() 2—①得2C(s)+4H2(g)+O2(g) = 2CH3OH(l) 的ΔH=(a-2b-2c)kJ/mol。
2—①得2C(s)+4H2(g)+O2(g) = 2CH3OH(l) 的ΔH=(a-2b-2c)kJ/mol。
因此,本题正确答案为:a-2b-2c;
(3)KW只与温度有关,且温度升高KW变大,由图可知,温度B>C>A=D=E,所以KW间的关系是B>C>A=D=E;
因此,本题正确答案为:B>C>A=D=E;
(4)由图可知,A点和D点温度相同,A点为中性,D点为酸性,
a.升温会使温度升高,不符合题意,故不选a;
b.加入少量的NaOH碱性增强,不符合题意,故不选b;
c.加入少量的NH4Cl,由于NH4+水解使溶液显酸性,c(H+)>c(OH-),故c符合题意,选c。
因此,本题正确答案为:c;
(5)E对应的温度下为常温,KW=1![]() 10-14,酸和碱都抑制水的电离,NaOH溶液中由水电离出的H+等于溶液中的H+,H2SO4 溶液中由水电离出的H+浓度等于溶液中的OH-,则在pH=9的NaOH溶液与pH=4的H2SO4 溶液中,水电离出的H+浓度之比为:
10-14,酸和碱都抑制水的电离,NaOH溶液中由水电离出的H+等于溶液中的H+,H2SO4 溶液中由水电离出的H+浓度等于溶液中的OH-,则在pH=9的NaOH溶液与pH=4的H2SO4 溶液中,水电离出的H+浓度之比为:![]() =10:1;
=10:1;
若将两溶液混合所得溶液的pH=7,则NaOH溶液与H2SO4溶液恰好完全反应,设NaOH溶液与H2SO4溶液的体积分别为V1、V2,则![]()
因此,本题正确答案为:c ;10:1 ;10:1。

【题目】t℃时,在体积不变的容器中发生反应X(g)+3Y(g) ![]() aZ(g) △H<0,各组分浓度如下表
aZ(g) △H<0,各组分浓度如下表
物质 | X | Y | Z |
初始浓度/ mol·L-1 | 0.1 | 0.3 | 0 |
2min末浓度/mol·L-1 | 0.08 | 0.04 | |
平衡浓度/mol·L-1 | 0.1 |
(1)0~2min的平均速率ν(Y) =___________________
(2)达平衡时X的转化率为___________________
(3)a =_______________
(4)平衡时Y的浓度为________________
(5)下列能表示该反应一定达到平衡状态的______________
①单位时间内生成n mol X的同时生成n mol Z
②c(X):c(Y):c(Z)的比值不再变化
③容器中的气体的质量不再变化
④容器中混合气体的平均相对分子质量不再变化
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)图中表示NO2的变化的曲线是___(填字母);
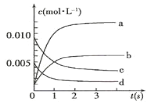
(2)800℃,反应达到平衡时,NO的转化率是___ ;
(3)用O2表示从0~2s内该反应的平均速率v=___。