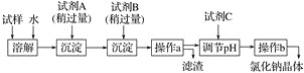
【题目】某化学实验小组从商店买回的浓硫酸试剂标签的部分内容破损。由于试剂瓶口密封签已破损,他们怀疑该硫酸的质量分数与标签不符,决定开展研究。部分破损标签内容为硫酸:化学纯(CP) 品名:硫酸, 化学式:H2SO4相对分子质量:98,质量分数:98% 密度:1.84g/cm3。甲同学认为,可以用一种精密仪器测量该溶液的c(H+),若c(H+)=36.8 mol·L-1,则该溶液的质量分数为98%。乙同学认为,即使有精密的仪器,甲同学的方案也不行,建议用重量分析法来测定。具体设想:取一定体积的该硫酸与足量氯化钡溶液反应,过滤、洗涤、干燥沉淀,称量沉淀的质量。丙同学则建议用中和滴定法进行测定,设想如下:①准确量取一定体积的硫酸,用适量的水稀释;②往稀释后的溶液中滴入几滴指示剂;③用碱式滴定管量取标准浓度的氢氧化钠溶液滴定,直到出现滴定终点为止;④记录消耗的氢氧化钠溶液的体积。
请回答下列问题:
(1)乙同学推测甲同学的方案不可行的理由是_____________________________________
(2)乙同学的方案的关键操作有两点:①确保SO42-完全沉淀;②洗涤沉淀,确保沉淀不含杂质。在实际中,请设计简单实验检验SO42-是否完全沉淀:____________________________
检验沉淀是否洗净的操作方法是__________________________________________________;
(3)在丙同学的方案中步骤②用到的指示剂是____________;达到滴定终点的标志是______________________________________________________________________________。
(4)丙同学的方案中,下列操作使测定结果偏小的是_____________。
①在滴定前未用NaOH标准溶液润洗滴定管,②滴定前滴定管尖嘴部分有气泡,滴定后滴定管尖嘴部分仍有气泡,③锥形瓶用蒸馏水洗净后,没有用待测液润洗,④滴定前,仰视读数,滴定后,仍仰视读数,⑤滴定前,仰视读数,滴定后,俯视读数
(5)丙同学在实验中,分别取等体积原硫酸,用NaOH溶液滴定三次,终点时,得到的NaOH溶液体积如下表所示:
实验序号 | 硫酸体积 | NaOH溶液体积 | NaOH溶液浓度 |
① | 5.00 mL | 35.65 mL | 5.00 mol·L-1 |
② | 5.00 mL | 39.65 mL | 5.00 mol·L-1 |
③ | 5.00 mL | 35.55 mL | 5.00mol·L-1 |
通过计算,该浓硫酸物质的量浓度为____________________________________________。是否与标签上表示的溶质质量分数相同___________(填“是”或“否”)