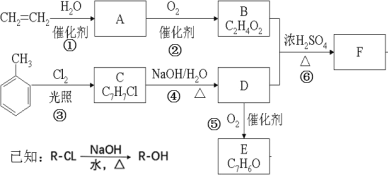
【题目】丁酸乙酯广泛应用于食用香精配方中,可调配多种果香型香精。实验室制备丁酸乙酯的反应、装置示意图(如图)和有关数据如下:
密度/(g/cm3) | 沸点/℃ | 水中溶解性 | |
正丁酸 | 0.9587 | 163 | 溶 |
丁酸乙酯 | 0.877 | 121 | 难溶 |

实验步骤:在A中加入10.0g的乙醇、8.80g的丁酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集120~123℃馏分,得丁酸乙酯4.80g。
回答下列问题:
(1)仪器B中,冷凝水从_____(填“a”或“b”)口进。
(2)在洗涤操作中,第一次水洗的主要目的是____,饱和碳酸氢钠溶液的作用是____,第二次水洗的主要目的是_____。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后____(填序号)。
a.直接将丁酸乙酯从分液漏斗的上口倒出
b.先将水层从分液漏斗的下口放出,再将丁酸乙酯从下口放出
c.直接将丁酸乙酯从分液漏斗的下口放出
d.先将水层从分液漏斗的下口放出,再将丁酸乙酸从上口倒出
(4)实验中加入过量乙醇的目的是_________。
(5)实验中加入少量无水MgSO4的目的是________。
(6)本实验的产率是____(保留三位有效数字)。
【题目】下表中阿拉伯数字(1、2…)是元素周期表中行或列的序号。请参照元素A~I在周期表中的位置,回答下列问题。
1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 | |
1 | A | |||||||
2 | B | C | D | E | ||||
3 | F | G | H | I |
(1)B、C两元素中非金属性较强的是________(写出元素名称),I元素在周期表中的位置是__________。
(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式_________。
(3)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1∶1和1∶2的两种共价化合物X和Y,请写出Y的电子式_________,该元素还能与A~I中的另一种元素以原子个数之比为1∶1和1∶2形成两种离子化合物Z和M,用电子式表示M的形成过程:____。
(4)表中某两种元素的气态单质可以形成燃料电池,其产物清洁无污染,请写出碱性环境中负极反应式____。