【题目】KIO3 是一种重要的无机化合物,可作为食盐中的补碘剂。利用“KClO3 氧化法”制备 KIO3 工艺流程如下图所示,回答下列问题:
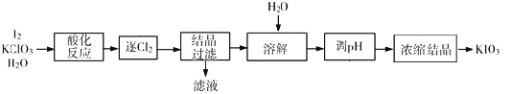
(1)“酸化反应”所得产物有 KH(IO3)2、Cl2 和 KCl。“逐 Cl2”采用的方法是________;
(2)“滤液”中的溶质主要是_______;“调 pH”中发生反应的化学方程式为_____________________;
(3)结晶过滤时工人发现 KH(IO3)2 为悬浮絮状沉淀,以下可以采用的方法是________;
A.倾析法 B.重结晶法 C.抽滤法 D. 离心分离法
(4)生产中,如果省去“酸化”、“逐氯”、“结晶①、过滤”这三步操作,直接用试剂 X 调整反应后溶液的 pH,对生产碘酸钾有什么具体影响_________________________________________________________________;
(5)KIO3 也可采用“电解法”制备,装置如图所示。与“电解法”相比,“KClO3 氧化法”的主要不足之处有_____________________________________;(写出一点)

(6)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-。测定加碘食盐中碘的含量,学生甲设计的实验步骤如下:
a.准确称取 w g 食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量 KI 溶液,使 KIO3 与 KI 反应完全;
c.以淀粉为指示剂,加入物质的量浓度为2.0×10-3mol·L-1 的 Na2S2O3 溶液 10.0mL 恰好反应。 则加碘食盐样品中的碘元素含量是______________mg/kg;(以含 w 的代数式表示)
(7)学生乙又对纯净的 NaCl(不含 KIO3)进行了下列实验:
操作步骤 | 实验现象 |
取 1g 纯净的 NaCl,加 3mL 水配成溶液。 | 溶液无变化 |
滴入 5 滴淀粉溶液和 1mL 0.1 mol·L-1KI 溶液,振荡。 | 溶液无变化 |
然后再滴入 1 滴 1mol·L-1 的 H2SO4,振荡。 | 溶液变蓝色 |
根据学生乙的实验结果,请对学生甲的实验结果作出简要评价___________________________。
【题目】已知常温下浓度均为0.1 mol·L-1的下列溶液的pH如表:
溶质 | NaF | Na2CO3 | NaClO | NaHCO3 |
pH | 8.1 | 11.6 | 9.7 | 8.4 |
下列有关说法正确的是( )
A. 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B. 等体积、等物质的量浓度的NaClO溶液与NaF溶液中离子总数大小:N前<N后
C. 若将少量CO2通入NaClO溶液至溶液中,离子方程式为:ClO-+CO2+H2O=HClO+CO32-
D. 向Na2CO3溶液中通入少量的HF气体,化学方程式为Na2CO3+2HF = CO2+H2O+2NaF
【题目】
(一) 现代铝的精炼研究方向是减低能耗。如图 :室温下通过电解在阴极沉积纯铝,A1Br3 在苯(简写 ArH)中可以生成[A12Br5ArH]+和 Br-。

(1)阳极的材料________;
(2)写出阴极沉积铝的电极方程式__________________________________________;
(二)邻硝基苯甲酸是重要的医院中间体,最新合成方法是邻硝基甲苯和高锰酸钾在相转移催化剂季铵盐(Q+X-)氧化、酸化合成,其原理如下:

相转移催化原理如下:

有关物质的物理性质如下表:
物质 | 邻硝基苯甲酸 | 高锰酸钾 | 苄基三乙基氯化铵(C6H5-CH2CH2)N(C2H5)3Cl | 聚乙二醇 | 四丁基溴化铵(C4H9)4NBr | NH4Cl |
水 | 难溶 | 易溶 | 可溶 | 任意比互溶溶 | 可溶 | 易溶 |
有机物 | 易溶 | 难溶 | 易溶 | 易溶 | 易溶 | 难溶 |
下列说法不合理的是________;
A.相转移催化剂作用主要决定于 Q+的物理化学性质
B.反应中为了防止温度剧烈升高,投料应该分批加入
C.Q+X-是通过增大反应接触面积提高反应速率
D.增大压强可以提高邻硝基甲苯氧化的反应限度
E.工业使用季铵盐(Q+X-)可以提高邻硝基苯甲酸产率
(2)四丁基溴化铵(C4H9)4NBr 萃取水中的高锰酸钾的方程式为:KMnO4(aq) +Q+X-(aq) →Q+ MnO4- (aq) +KX(aq),写出平衡常数 k 的表达式________________;设n(Q+X-):n(邻硝基甲苯)=x,理论证明当 x=5%邻硝基甲酸产率 y 得到最大值,请画出 y 随 x 变化的示意图________________ 。
(3)实验表明,当温度 100℃、反应时间 2.5h,n(KMnO4): n(邻硝基甲苯)=3:1,催化剂用量相同,Q+X-反应的催化效果如下:
相转移催化剂 | 苄基三乙基氯化铵 (C6H5-CH2CH2) N(C2H5)3Cl | 聚乙二醇 | 四丁基溴化铵 (C4H9)4NBr |
产率% | 46.7 | 20.0 | 53.1 |
苄基三乙基氯化铵比四丁基溴化铵催化效果差的原因_____________________________;工业生产不用聚乙二醇做催化剂的主要原因____________________________________ ;
(4)(C4H9)4NBr 为催化剂,邻硝基甲苯和高锰酸钾反应,测得溶液酸碱性对产率、反应时间影响如图 ,下列推测合理的是________。

A.溶液碱性强产率降低是因为季铵盐发生水解反应
B.pH=2 高锰酸钾一定发生副反应
C.选择 pH=7、适当升温可以提高产率
D.工业可以选择浓硝酸替代高锰酸钾做氧化剂,减缓对设备的腐蚀
【题目】现用邻苯二甲酸氢钾标准溶液来测定NaOH溶液的浓度.用氢氧化钠溶液来滴定邻苯二甲酸溶液时有下列操作:
①向溶液中加入1~2滴指示剂 ②取20mL标准溶液放入锥形瓶中
③用氢氧化钠溶液滴定至终点 ④重复以上操作
⑤用天平精确称取5.105g邻苯二甲酸氢钾(相对分子质量为204.2)固体配成250mL标准溶液(测得pH约为4.2).
⑥根据实验数据计算氢氧化钠的物质的量浓度.
(1)以上各步中,正确的(填序号)操作顺序是__,上述②中使用的仪器除锥形瓶外,还需要使用的仪器是__.选用指示剂是:__
(2)滴定,并记录NaOH的终读数.重复滴定几次,数据记录如下表:
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |
某同学在处理数据过程中计算得到平均消耗NaOH溶液的体积为:V(NaOH)=![]() =20.20mL,他的计算合理吗?理由是____,通过仪器测得第4次滴定过程中溶液pH随加入氢氧化钠溶液体积的变化曲线如图所示,则a____20.02(填“>”、“<”或“=”)
=20.20mL,他的计算合理吗?理由是____,通过仪器测得第4次滴定过程中溶液pH随加入氢氧化钠溶液体积的变化曲线如图所示,则a____20.02(填“>”、“<”或“=”)

(3)步骤②中在观察滴定管的起始读数时,要使滴定管的尖嘴部分充满溶液,如果滴定管内部有气泡,赶走气泡的操作__.
(4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测定的氢氧化钠溶液滴定,此操作对实验结果__(填“偏大”、“偏小”或“无影响”)