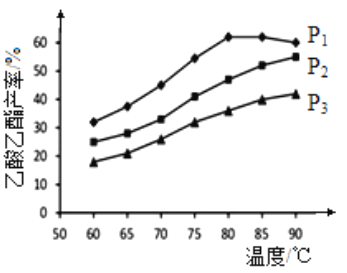
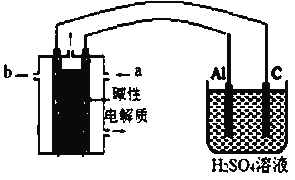
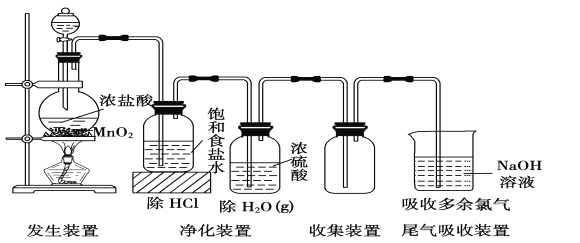
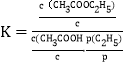0 194925 194933 194939 194943 194949 194951 194955 194961 194963 194969 194975 194979 194981 194985 194991 194993 194999 195003 195005 195009 195011 195015 195017 195019 195020 195021 195023 195024 195025 195027 195029 195033 195035 195039 195041 195045 195051 195053 195059 195063 195065 195069 195075 195081 195083 195089 195093 195095 195101 195105 195111 195119 203614