【题目】某实验小组对KSCN的性质进行探究,设计如下实验:
试管中试剂 | 实验 | 滴加试剂 | 现象 |
| Ⅰ | ⅰ.先加1mL 0.1 mol/L FeSO4溶液 ⅱ.再加硫酸酸化的KMnO4溶液 | ⅰ.无明显现象 ⅱ.先变红,后褪色 |
Ⅱ | ⅲ.先加1mL 0.05 mol/L Fe2(SO4)3溶液 ⅳ.再滴加0.5 mL 0.5 mol/L FeSO4溶液 | ⅲ.溶液变红 ⅳ.红色明显变浅 |
(1)SCN-存在两种结构式,分别为N≡C—S-和S=C=N-,SCN-是二者的互变异构的混合物,请写出N≡C—S-的电子式__________。
(2)用离子方程式表示FeSO4溶液显酸性的原因__________。
(3)①用离子方程式表示实验Ⅰ溶液变红的原因____________________________。

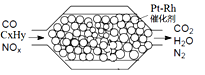
②针对实验Ⅰ中红色褪去的原因,小组同学认为是SCN-被酸性KMnO4氧化为SO42-,并设计如如图实验装置证实了猜想是成立的。其中X溶液是_______,Y溶液是_______,检验产物SO42-的操作及现象是_____________。
(4)针对实验Ⅱ“红色明显变浅”的现象,实验小组进行探究。
甲同学查资料得知:当加入强电解质后,增大了离子间相互作用,离子之间牵制作用增强,即“盐效应”。“盐效应”使Fe3++SCN-![]() [Fe(SCN)]2+平衡体系中的Fe3+跟SCN-结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
[Fe(SCN)]2+平衡体系中的Fe3+跟SCN-结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
乙同学认为SCN-可以与Fe2+反应生成无色络合离子,进一步使Fe3++SCN-![]() [Fe(SCN)]2+平衡左移,红色明显变浅,而Mg2+与SCN-难络合,于是乙设计了如下实验:
[Fe(SCN)]2+平衡左移,红色明显变浅,而Mg2+与SCN-难络合,于是乙设计了如下实验:

由此推测,实验Ⅱ“红色明显变浅”的原因是___________________。
(5)工业上测定钛铁合金中钛含量的其中一步反应原理是:以KSCN为指示剂,用NH4Fe(SO4)2标准溶液滴定Ti(Ⅲ),反应的化学方程式为:Ti2(SO4)3+2NH4Fe(SO4)2===2Ti(SO4)2+(NH4)2SO4+2FeSO4,则达到滴定终点的实验现象是______。
【题目】资料显示:自催化作用是指反应产物之一使该反应速率加快的作用。用稀硫酸酸化的KMnO4进行下列三组实验,一段时间后溶液均褪色(0.01mol/L可以记做0.01M)。
实验① | 实验② | 实验③ |
|
|
|
褪色 | 比实验①褪色快 | 比实验①褪色快 |
下列说法不正确的是
A. 实验①中发生氧化还原反应,H2C2O4是还原剂,产物MnSO4能起自催化作用
B. 实验②褪色比①快,是因为MnSO4的催化作用加快了反应速率
C. 实验③褪色比①快,是因为Cl—的催化作用加快了反应速率
D. 若用1mL0.2M的H2C2O4做实验①,推测比实验①褪色快