【题目】能源、环境与生产生活和社会发展密切相关。
(1)工业上利用CO和H2在催化剂作用下合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) ,已知反应中有关物质的化学键键能数据如下表所示:
CH3OH(g) ,已知反应中有关物质的化学键键能数据如下表所示:
化学键 | H—H | C—O | C≡O | H—O | C—H |
E/(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
则 CO(g)+2H2(g) ![]() CH3OH(g) △H=__________kJmol-1
CH3OH(g) △H=__________kJmol-1
(2)以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池。如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。

B极为电池______极,B极的电极反应式为_________________________________。
(3)参考合成反应CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数,回答下列问题:
CH3OH(g)的平衡常数,回答下列问题:
温度/℃ | 0 | 50 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 100 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
①该反应正反应是 ___________(填“放热”或“吸热”)反应;
②在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO转化率为50%,则T=__________℃。
(4)CH3OH也可由CO2和H2合成。在体积为1L的密闭容器中,充入lmolCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH= — 49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH= — 49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。
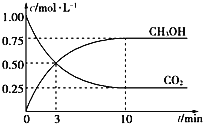
①该反应的平衡常数表达式为K=_______;从反应开始到10min,v(H2)=_____mol/(L·min);
②下列情况能说明该反应一定达到平衡状态的是___________(填字母)
A.v(CO2)消耗 = v(CH3OH)生成
B.气体的密度不再随时间改变
C.CO2和CH3OH的浓度之比不再随时间改变
D.气体的平均相对分子质量不再随时间改变
③为了加快化学反应速率且使体系中气体的物质的量增大,只改变下列某一条件,可采取的措施有__ (填字母)
A.升高温度 B.缩小容器体积
C.再充入CO2气体 D.使用合适的催化剂
④相同温度下,在另一个容积为1 L的密闭容器中充入2mol CH3OH(g)和2molH2O(g),达到平衡时CO2的浓度_______(填“>”、“ <”或“=”)0.25mol/L。
【题目】一定条件下,向密闭容器中加入 X物质,发生反应3X(g)![]() Y(g)+Z(g) ΔH<0,反应一定时间后改变某一个外界条件,反应中各时刻X物质的浓度如下表所示,下列说法中不正确的是
Y(g)+Z(g) ΔH<0,反应一定时间后改变某一个外界条件,反应中各时刻X物质的浓度如下表所示,下列说法中不正确的是
反应时间(min) | 0 | 5 | 15 | 17 | 20 |
X的浓度(mol/L) | 1.0 | 0.4 | 0.4 | 0.7 | 0.7 |
A. 0~5min时,该反应的速率为v(X)=0.12 mol/(L·min)
B. 15min时改变的条件不可能是升高温度
C. 5min时反应达到第一次平衡,该温度下的平衡常数数值为0.625
D. 从初始到18min时,X的转化率为30%
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。发生的反应如下:

CH3CH2CH2CH2OH![]() CH3CH2CH2CHO ,反应物和产物的相关数据列表如下:
CH3CH2CH2CHO ,反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.810 9 | 微溶 |
正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,与5 mL浓硫酸形成混合溶液,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在E中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77 ℃馏分,产量2.0 g。
回答下列问题:
(1)实验中,Na2Cr2O7溶液和浓硫酸添加的顺序为___________________________。
(2)加入沸石的作用是________________________________________________。
若加热后发现未加沸石,应采取的正确方法是______________________________。
(3)上述装置图中,D仪器的名称是________,E仪器的名称是________。
(4)分液漏斗使用前必须进行的操作是________。
(5)将正丁醛粗产品置于分液漏斗中分水时,正丁醛在_______________层(填“上”或“下”)。
(6)反应温度应保持在90~95 ℃,其原因是__________________________________、__________________________________________________。
(7)本实验中,正丁醛的产率为________%(结果保留两位小数)。
【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
t / s | 0 | 50 | 150 | 250 | 350 |
n(PCl3) / mol | 0 | 0. 16 | 0. 19 | 0. 20 | 0. 20 |
A. 体系平衡时与反应起始时的压强之比为5∶6
B. 反应在前50 s 的平均速率ν(PCl3)= 0. 0032 mol·L-1·s-1
C. 相同温度下,起始时向容器中充入0.6mol PCl5、0. 20 mol PCl3 和0. 20 mol Cl2,反应达到平衡前ν(正)>ν(逆)
D. 相同温度下,若起始时向容器中充入2. 0 mol PCl3 和2. 0 mol Cl2,达到平衡时,PCl3 的质量分数比上述平衡体系小






