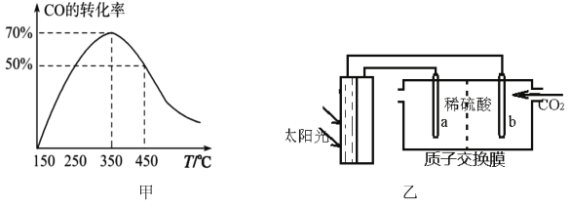
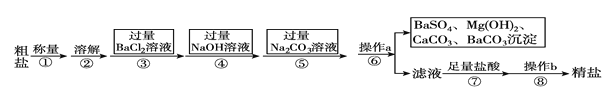
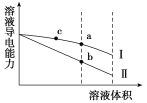
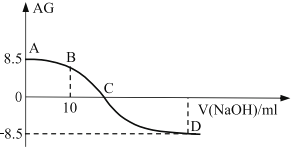
0 194406 194414 194420 194424 194430 194432 194436 194442 194444 194450 194456 194460 194462 194466 194472 194474 194480 194484 194486 194490 194492 194496 194498 194500 194501 194502 194504 194505 194506 194508 194510 194514 194516 194520 194522 194526 194532 194534 194540 194544 194546 194550 194556 194562 194564 194570 194574 194576 194582 194586 194592 194600 203614