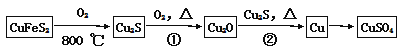
【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、CaO、MgO 等。现以硫酸渣制备铁红(Fe2O3),过程如下:

(1) 酸溶过程中Fe2O3与稀硫酸反应的离子方程式是_________________________。
(2) 还原过程中加入FeS2是将溶液中的Fe3+ 还原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式:__________________________________________。检验Fe3+被完全还原的实验操作和现象是:________________________________________________。
(3) 氧化过程中通入空气和加入NaOH是为了将溶液中的铁元素充分转化为沉淀而析出,写出有关的离子方程式:_____________________________________________。
(4) 生产过程中,为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是_____。
(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
(5) 滤液B可以回收的物质有____________________________________________。
【题目】Ⅰ.如图所示,一密闭容器被无摩擦、可滑动的两隔板a、b分成甲、乙两室;标准状况下,在乙室中充入NH30.4mol,甲室中充入HCl、N2的混合气体,静止时隔板位置如图所示。已知甲、乙两室中气体的质量之差为17.3g。
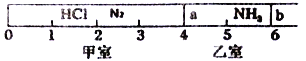
(1)甲室中HCl、N2的质量之比为__________________。
(2)将隔板a去掉,一段时间后,隔板b将稳定位于刻度“________’’处(填数字,不考虑固体物质产生的压强),此时体系的平均相对分子质量为________。
Ⅱ.已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶质的物质的量浓度/molL-1 | 溶液的密度/gcm-3 | |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为________(不写单位,用含c1、ρ1,的代数式表示)。
(2)物质的量浓度为c1molL-1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为________molL-1。
(3)将物质的量浓度分别为c2molL-1和0.2c2molL-1的氨水等质量混合,所得溶液的物质的量浓度__________0.6c2molL-1(填“大于”、“小于”或“等于”)(设混合后溶液的体积变化忽略不计)
Ⅲ.电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极)。

若用NO2气体进行模拟电解法吸收实验。
①写出电解时NO2发生反应的电极反应式:_________________________________。
②若有标准状况下2.24LNO2被吸收,通过阳离子交换膜的H+为________mol。
【题目】如图所示,密闭筒形容器中,有活塞位于距全长一端1/5处,左边为空气,右边为H2、O2混合气体,标准状况下,若将H2、O2混合气体点燃引爆,活塞先左弹,恢复到原来温度后,活塞右滑停留在筒的中央,则原来H2、O2的物质的量比可能为 ( )
空气 | H2、O2的混合气 |
A. 7:1 B. 1:1 C. 1:3 D. 4:1