【题目】乙酸正丁酯是医药合成的重要中间体,某同学在实验室中用乙酸和正丁醇来制取,实验操作如下:
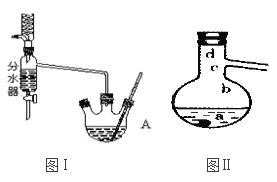
Ⅰ.将混合液(18.5 mL正丁醇和13.4 mL乙酸(过量),0.4 mL浓硫酸)置于仪器A中并放入适量沸石(见图I,沸石及加热装置等略去),然后加热回流约20分钟。
Ⅱ.将反应后的溶液进行如下处理:①用水洗涤,②用试剂X干燥,③用10% Na2CO3溶液洗涤。
Ⅲ.将所得到的乙酸正丁酯粗品转入蒸馏烧瓶中进行蒸馏,最后得到17.1 g乙酸正丁酯。
部分实验数据如下表所示:
化合物 | 相对分子质量 | 密度/(g·mL-1) | 沸点/℃ | 溶解度(g)/(100 g水) |
正丁醇 | 74 | 0.80 | 118.0 | 9 |
乙酸 | 60 | 1.045 | 118.1 | 互溶 |
乙酸正丁酯 | 1 1 6 | 0.882 | 126.1 | 0.7 |
(1)仪器A的名称是_________,使用分水器(实验中可分离出水)能提高酯的产率,其原因是______________________.
(2)步骤Ⅱ中的操作顺序为____________(填序号),用Na2CO3溶液洗涤的目的是____________,试剂X不能选用下列物质中的______________(填字母序号)。
a.无水硫酸镁 b.新制生石灰 c.无水硫酸钠
(3)步骤Ⅲ(部分装置如图Ⅱ所示)。
①蒸馏过程中需要使用_________形冷凝管,当仪器连接好后,a.向相应的冷凝管中通冷凝水;b.加热蒸馏烧瓶的先后顺序是___________。(填“先a后b"或“先b后a”)
②温度计水银球所处的位置不同,会影响馏出物的组成,当温度计水银球分别位于图Ⅱ中的________(填“a”“b”“c”或“d”)点时会导致收集到的产品中混有较多的低沸点杂质。
(4)该实验乙酸正丁酯的产率是_____________。(计算结果保留2位有效数字)。
【题目】如表是元素周期表的一部分,参照元素在表中的位置,请用化学用语回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
4 |
(1)这些元素中,化学性质最不活泼原子的原子结构示意图为__________;气态氢化物中,最稳定的是___________;最高价氧化物对应水化物中,酸性最强的是______________。
(2)①和④两种元素的原子按1:1组成的常见化合物的电子式为___________________。
(3)②、③的单质中更容易与①的单质反应的是___________________(用化学式表示)。
(4)④、⑦、⑧、⑨的简单离子半径由大到小的顺序为___________________ (用离子符号和“>”表示)。
(5)⑥和⑧的最高价氧化物对应水化物之间发生反应的离子方程式____________________。
(6)⑤⑨三种元素的单质沸点由高到低的顺序是________________(用化学式和“>”表示)。
(7)⑦⑧两元素相比较,金属性较强的是_____________ (填名称),可以验证该结论的实验是____________________(填字母)。
A.将在空气中放置已久的这两种元素的块状单质分别放入热水中
B.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
C.将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
D.比较这两种元素的气态氢化物的稳定性