��Ŀ����
����Ŀ��������������ҽҩ�ϳɵ���Ҫ�м��壬ijͬѧ��ʵ�����������������������ȡ��ʵ��������£�
�����Һ��18.5 mL��������13.4 mL���ᣨ��������0.4 mLŨ���ᣩ��������A�в�����������ʯ����ͼI����ʯ������װ�õ���ȥ����Ȼ����Ȼ���Լ20���ӡ�
����Ӧ�����Һ�������´���������ˮϴ�ӣ������Լ�X�������10% Na2CO3��Һϴ�ӡ�
��.�����õ���������������Ʒת��������ƿ�н����������õ�17.1 g������������
����ʵ���������±���ʾ��
������ | ��Է������� | �ܶ�/(g��mL��1) | �е㣯�� | �ܽ��(g)/��100 gˮ�� |
������ | 74 | 0.80 | 118.0 | 9 |
���� | 60 | 1.045 | 118.1 | ���� |
���������� | 1 1 6 | 0.882 | 126.1 | 0.7 |
(1)����A��������_________��ʹ�÷�ˮ����ʵ���пɷ����ˮ����������IJ��ʣ���ԭ����______________________.
(2)������еIJ���˳��Ϊ____________������ţ�����Na2CO3��Һϴ�ӵ�Ŀ����____________���Լ�X����ѡ�����������е�______________������ĸ��ţ���
a����ˮ����þ b��������ʯ�� c����ˮ������
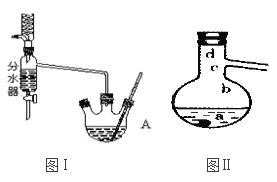
(3)�������װ����ͼ����ʾ����
�������������Ҫʹ��_________�������ܣ����������Ӻú�a������Ӧ����������ͨ����ˮ��b������������ƿ���Ⱥ�˳����___________�������a��b"����b��a����
���¶ȼ�ˮ����������λ�ò�ͬ����Ӱ����������ɣ����¶ȼ�ˮ����ֱ�λ��ͼ���е�________���a����b����c����d������ʱ�ᵼ���ռ����IJ�Ʒ�л��н϶�ĵͷе����ʡ�
(4)��ʵ�������������IJ�����_____________��������������2λ��Ч���֣���
���𰸡� ������ƿ ���Ϸ����ˮ��ʹ������H2OŨ�ȱ�С��������ƽ����������Ӧ�����ƶ� �٢ۢ٢� ��ȥ�����ڲ�Ʒ�е��ᣨ��������˵��Ҳ�ԣ� b ֱ ��a��b a��b 74%
����������1����װ��ͼ��֪����A��������������ƿ����ˮ���������ʹ������ˮ��Ũ�ȼ�С��������������Ӧ���ҽ��У�����ʹ�÷�ˮ����ʵ���пɷ����ˮ����������IJ��ʣ���2��������ˮ��ȥ�ֿ�����ˮ����������ʣ�����Na2CO3��Һ��ȥ�������ᣬ����ˮ��ȥ�����ڲ�Ʒ�е�Na2CO3��Һ��������ˮ�����������ȥ�����Բ�����еIJ���˳��Ϊ�٢ۢ٢ڣ���CaO��ˮ�����ɼ�ᵼ����ˮ�⣬�ʲ�����CaO�������������ѡb����3����ΪʹҺ����Ʒ��ȫ��˳���ؽ���������У�Ӧʹ��ֱ�������ܣ�Ϊȷ���������ȫ��Һ����Ӧ������������ͨ��ȴˮ��Ȼ�������ƿʹ�¶�Ѹ�����µ��е㣬�����Ⱥ�˳������a��b����ͬһ��ƿ�У���ӦҺ���¶ȸ��������¶ȣ������¶ȴ��������¶����ͣ��ʵ��¶ȼƵ�ˮ�������������ƿ��֧�ܿڴ�ʱ�����н϶�е�ϵ͵����ʼ������������У�����λ��ͼ���е�a��b����4��18.5mL��������������18.5 mL��0.8 g/mL=14.8 g���������ϵõ�������������������x����
CH3COOH+CH3CH2CH2CH2OH![]() CH3COOCH2CH2CH2CH3+H2O
CH3COOCH2CH2CH2CH3+H2O
74 g 116 g
14.8 g x
����x=(116 g��14.8 g)��74 g=23.2 g
���������������IJ����ǣ�17.1 g/23.2 g��100%=74%��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ��ij�о�С�齫һ�����ӷ���������õ���Cu��Al��Fe������Au��Pt�Ƚ����Ļ�������������Ʊ�����ͭ�������ˮ�Ȼ����ķ�����

��֪��Cu2++4NH3��H2O=[Cu(NH3)4]2++4H2O
��ش��������⣺
��1�������Cu���ᷴӦ�����ӷ���ʽΪ_________________________��
��2������ڼ�H2O2��������______________������2Ϊ���ѧʽ��__________��
��3������ݲ���ֱ�Ӽ�����ˮ��������________
��4������Һ1��Cu2+��Ũ��Ϊ0.02mol��L-1����������ͭ��ʼ����ʱ��pH=________����֪��Ksp[Cu(OH)2]=2.0x10-20��
��5����֪��2Cu2++4I-=2CuI��+I2 I2+2S2O32-=2I-+S4O62-
ijͬѧΪ�˲ⶨCuSO4��5H2O��Ʒ�����������ɰ����·�����ȡ3.00g��Ʒ����ˮ�ܽ����������KI��Һ����ַ�Ӧ����ˡ�ϴ�ӣ�����Һϡ����250mL��ȡ50mL���������Һ��ָʾ������0.080mol��L-1Na2S2O3����Һ�ζ����ﵽ�ζ��յ��������______________��
�Ĵ�ƽ��ʵ���ȥNa2S2O3����Һ�������£�
ʵ����� | 1 | 2 | 3 | 4 |
����Na2S2O3����Һ��mL�� | 25.00 | 25.02 | 26.20 | 24.98 |
�˲�Ʒ��CuSO4��5H2O����������Ϊ__________��


