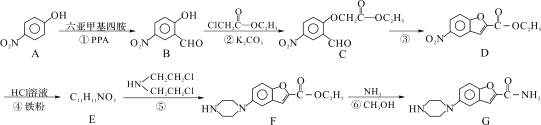
0 181199 181207 181213 181217 181223 181225 181229 181235 181237 181243 181249 181253 181255 181259 181265 181267 181273 181277 181279 181283 181285 181289 181291 181293 181294 181295 181297 181298 181299 181301 181303 181307 181309 181313 181315 181319 181325 181327 181333 181337 181339 181343 181349 181355 181357 181363 181367 181369 181375 181379 181385 181393 203614