【题目】用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20mL 0.1mol·L﹣1H2C2O4溶液 | 30mL 0.01mol·L﹣1KMnO4溶液 |
② | 20mL 0.2mol·L﹣1H2C2O4溶液 | 30mL 0.01mol·L﹣1KMnO4溶液[来 |
(1)该实验探究的是 因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是 > (填实验序号).
(2)若实验①在2min末收集了2.24mL CO2(标准状况下),则在2min末,c(MnO4﹣)= mol/L.
(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率.
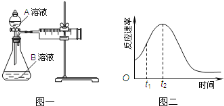
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是: .