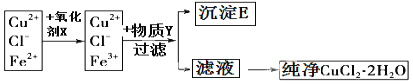
【题目】在氯化铜晶体(CuCl22H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其溶于水后加少量盐酸配制成水溶液,然后按如图所示的操作步骤进行提纯.
已知室温下,下列各物质的KSP:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp(25 ℃) | 8.0×10-16 | 2×10-20 | 4.0×10-38 |
(1)下列物质都可以作为氧化剂,其中最适合本实验的是 。
A.H2O2 B.KMnO4 C.HNO3 D.K2Cr2O7
写出你所选用的氧化剂在该实验中的发生反应的离子方程式: 。
(2)物质Y是 ,沉淀E的化学式 。
(3)从滤液得到纯净的CuCl22H2O晶体应采用的方法是 ,过滤、洗涤。
(4)假设加入Y之后Cu2+的浓度为0.02 mol/L,要使 Cu2+不水解,则加入Y后溶液的pH不能超过 。
【题目】已知Ca(OH)2、CaCO3和Ca(HCO3)2都是电解质,进行如图所示的实验,请将实验现象填入下表中的空格处。

实验操作 | 灯泡亮度变化 |
(1)通入CO2之前 | 亮 |
(2)开始通入CO2时 | |
(3)恰好完全沉淀 | |
(4)沉淀完全后,继续通入过量CO2 | |
(5)再通入CO2 |

