0 15335 15343 15349 15353 15359 15361 15365 15371 15373 15379 15385 15389 15391 15395 15401 15403 15409 15413 15415 15419 15421 15425 15427 15429 15430 15431 15433 15434 15435 15437 15439 15443 15445 15449 15451 15455 15461 15463 15469 15473 15475 15479 15485 15491 15493 15499 15503 15505 15511 15515 15521 15529 203614
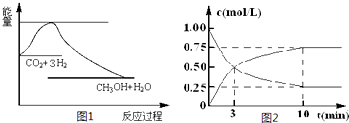
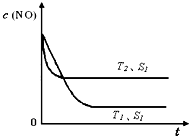 (2012?佛山二模)2012年2月27日深圳宣称进入“200万辆汽车时代”,汽车尾气已成为重要的空气污染物.
(2012?佛山二模)2012年2月27日深圳宣称进入“200万辆汽车时代”,汽车尾气已成为重要的空气污染物.