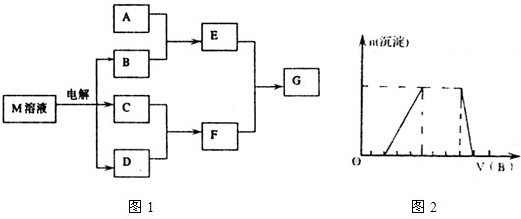
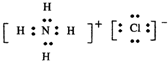0 15287 15295 15301 15305 15311 15313 15317 15323 15325 15331 15337 15341 15343 15347 15353 15355 15361 15365 15367 15371 15373 15377 15379 15381 15382 15383 15385 15386 15387 15389 15391 15395 15397 15401 15403 15407 15413 15415 15421 15425 15427 15431 15437 15443 15445 15451 15455 15457 15463 15467 15473 15481 203614
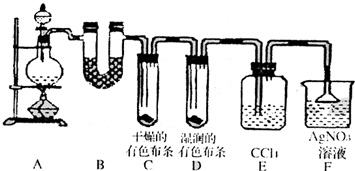 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题.