0 11337 11345 11351 11355 11361 11363 11367 11373 11375 11381 11387 11391 11393 11397 11403 11405 11411 11415 11417 11421 11423 11427 11429 11431 11432 11433 11435 11436 11437 11439 11441 11445 11447 11451 11453 11457 11463 11465 11471 11475 11477 11481 11487 11493 11495 11501 11505 11507 11513 11517 11523 11531 203614
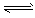 2NH3(g);△H<0,请回答:
2NH3(g);△H<0,请回答: FeO (s) + CO (g)的平衡常数为K1,
FeO (s) + CO (g)的平衡常数为K1, FeO (s) + H2 (g)的平衡常数为K2,
FeO (s) + H2 (g)的平衡常数为K2,
 CO (g) + H2O (g),写出该反应的平衡常数K3的数学表达式______________。
CO (g) + H2O (g),写出该反应的平衡常数K3的数学表达式______________。 zC(g)平衡时测得A的浓度为
zC(g)平衡时测得A的浓度为 2SO3(g) △H<0,并达到平衡状态。下列说法中,正确的是
2SO3(g) △H<0,并达到平衡状态。下列说法中,正确的是  N2O4(g) △H<0 在测定NO2的相对分子质量时,下列条件中测定结果误差最小的是
N2O4(g) △H<0 在测定NO2的相对分子质量时,下列条件中测定结果误差最小的是  2SO3
2SO3  2Z(g)在一定条件下的达到平衡后,t1和t2时各改变某一种外界条件,化学反应速率(v)-时间(t)图象如图。则下列说法中正确的是
2Z(g)在一定条件下的达到平衡后,t1和t2时各改变某一种外界条件,化学反应速率(v)-时间(t)图象如图。则下列说法中正确的是 

 2SO3的平衡体系中,用由18O构成的氧气(18O2)替换掉一部分O2,平衡不发生移动。一段时间后SO2中18O的含量_________(填增加、减少或不变),其原因是__________。
2SO3的平衡体系中,用由18O构成的氧气(18O2)替换掉一部分O2,平衡不发生移动。一段时间后SO2中18O的含量_________(填增加、减少或不变),其原因是__________。 H2(g) + I2(g)达到平衡后。回答下列问题(用 “>”、“<” 或“=”填空):
H2(g) + I2(g)达到平衡后。回答下列问题(用 “>”、“<” 或“=”填空): HCl + HClO
HCl + HClO 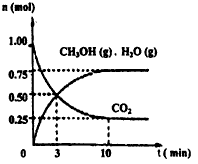
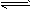
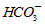 +H+的电离平衡常数 K=__________ 。(已知:10-5.6=2.5×10-6)
+H+的电离平衡常数 K=__________ 。(已知:10-5.6=2.5×10-6) CH3CH2OH(g)+3H2O(g) ΔH=a kJ/mol,在一定压强下,测得该反应的实验数据如下表。请根据表中数据分析
CH3CH2OH(g)+3H2O(g) ΔH=a kJ/mol,在一定压强下,测得该反应的实验数据如下表。请根据表中数据分析