题目内容
5.按微粒半径递增顺序排列的一组原子或离子是( )| A. | F-、O2-、S2- | B. | O、P、S | C. | K+、Ca2+、Li+ | D. | Al3+、Mg2+、Li+ |
分析 电子层结构相同的离子,核电荷数越大离子半径越大,电子层越多离子半径越大;
同周期自左而右原子半径减小、同主族自上而下原子半径增大.
解答 解:A.电子层结构相同的离子,核电荷数越大离子半径越大,电子层越多离子半径越大,故离子半径F-<O2-<S2-,故A符合;
B.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径O<S<P,故B不符合;
C.电子层结构相同的离子,核电荷数越大离子半径越大,电子层越多离子半径越大,故离子半径:Li+<Ca2+<K+,故C不符合;
D.电子层结构相同的离子,核电荷数越大离子半径越大,电子层越多离子半径越大,故离子半径:Li+<Al3+<Mg2+,故D不符合,
故选:A.
点评 本题考查微粒比较大小比较,比较基础,明确比较规律即可解答,旨在考查学生对基础知识的掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列说法正确的是( )
| A. | 在25℃、1.01×105Pa的条件下,22.4L H2中含有的分子数为0.1NA | |
| B. | 1L 1mol•L-1的CaCl2溶液中含Cl-的数目为2NA | |
| C. | 40g NaOH溶解在1L水中,所制得的100mL溶液中含Na+数为0.1NA | |
| D. | 22g CO2与标准状况下11.2L H2O含有相同分子数 |
16.下列有关化学用语正确的是( )
| A. | Na+的基态电子排布图是: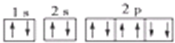 | |
| B. | 质量数之和是质子数之和两倍的水分子符号可能是:D${\;}_{2}^{1}$O | |
| C. | Na22的电子式: | |
| D. | 氯离子结构示意图为: |
13. 反应:aA(g)+bB(g)cC(g)+dD(g)中A的转化率和含量符合如图所示变化关系,下列叙述中,正确的是.
反应:aA(g)+bB(g)cC(g)+dD(g)中A的转化率和含量符合如图所示变化关系,下列叙述中,正确的是.
 反应:aA(g)+bB(g)cC(g)+dD(g)中A的转化率和含量符合如图所示变化关系,下列叙述中,正确的是.
反应:aA(g)+bB(g)cC(g)+dD(g)中A的转化率和含量符合如图所示变化关系,下列叙述中,正确的是.| A. | 压强P1比P2大 | B. | (a+b)比(c+d)大 | ||
| C. | 温度t1℃比t2℃低 | D. | 正反应为吸热反应. |
14.根据化学反应2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g),取n(SO2):n(O2)相同,总质量也相同的混合气体(不含SO3)两份,分别置于密闭容器A、B内,A、B两容器均能使其中的温度保持不变,且开始时容积一样,A中的气体压强不变,B中体积不变,设A、B中的正反应速率分别为a、b,逆反应速率分别为a′、b′,在反应过程中,下列关系中正确的是( )
| A. | a=b | B. | a<b | C. | a′>b′ | D. | a′=b′ |
15. 是物质间发生化学反应时颜色的变化情况,下列选项中正确的是( )
是物质间发生化学反应时颜色的变化情况,下列选项中正确的是( )
 是物质间发生化学反应时颜色的变化情况,下列选项中正确的是( )
是物质间发生化学反应时颜色的变化情况,下列选项中正确的是( )| M | N | P | Q | |
| A | NH3•H2O | Ba(OH)2 | 铜 | 石蕊试液 |
| B | Na | BaCl2 | FeO | KSCN |
| C | NaOH | Ba(NO3)2 | 锌粉 | KSCN |
| D | NaHCO3 | MgCl2 | Fe | 石蕊试液 |
| A. | A | B. | B | C. | C | D. | D |
 .
. .
. ,则S32-的电子式为
,则S32-的电子式为 .已知Na2S3+2HCl═2NaCl+H2S↑+2S↓,试写出Na2S5与醋酸反应的离子方程式:S52-+2CH3COOH=2CH3COO-+H2S+4S↓.工业上常用电解熔融NaCl制Na,事实上电解许多熔融的钠的化合物也能制备Na,如NaOH、Na2CO3.试写出电解熔融NaOH的反应方程式:4NaOH=4Na+O2+2H2O,若电解熔融Na2CO3时有CO2气体产生,则阳极电极反应式为2CO32--4e-=2CO2+O2.
.已知Na2S3+2HCl═2NaCl+H2S↑+2S↓,试写出Na2S5与醋酸反应的离子方程式:S52-+2CH3COOH=2CH3COO-+H2S+4S↓.工业上常用电解熔融NaCl制Na,事实上电解许多熔融的钠的化合物也能制备Na,如NaOH、Na2CO3.试写出电解熔融NaOH的反应方程式:4NaOH=4Na+O2+2H2O,若电解熔融Na2CO3时有CO2气体产生,则阳极电极反应式为2CO32--4e-=2CO2+O2.