题目内容
【题目】欲配制浓度为1.00mol·L-1的氯化钠溶液100mL,用不到的仪器是
A. 容量瓶 B. 分液漏斗 C. 玻璃棒 D. 烧杯
【答案】B
【解析】试题分析:欲配制浓度为1.00mol/L的氯化钠溶液100mL,需要的仪器有100ml的容量瓶、溶解溶质的烧杯和搅拌使用的玻璃棒,不需要的仪器是分液漏斗,因此选项是B。

 全能测控期末小状元系列答案
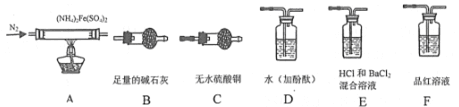
全能测控期末小状元系列答案【题目】煤燃烧产生的SO2是引起酸雨的原因之一。
(1)每隔一定时间测定某处雨水样品的pH值:
![]()
雨水样品pH值变小的主要原因是____________________。
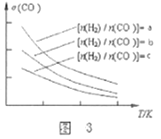
(2)反应2SO2(g)+O2(g)![]() 2SO3(g)+Q (Q>0),其化学平衡常数表达式_______;升高温度,K____________(填“变大”或者“变小”)。
2SO3(g)+Q (Q>0),其化学平衡常数表达式_______;升高温度,K____________(填“变大”或者“变小”)。
(3)判断已达到化学平衡状态的描述是______(选填编号)。
a.体系的压强不再发生变化 | b.2υ正(SO2)=υ逆(O2) |
c.c(SO2) = c(SO3) | d.气体总质量不再变化 |
(4)防治酸雨常用的措施:向煤中加石灰,减少 SO2的产生。这种煤燃烧后,大部分硫元素最终转化为固体盐是_____________。
(5)把CO2气体通入澄清的石灰水,立即会产生浑浊,但把SO2气体通入澄清的石灰水,却不容易看到浑浊,而CaCO3和CaSO3都是难溶的电解质,试说明原因:_____________________。
(6)Na2SO3溶液呈碱性,可吸收尾气SO2。Na2SO3溶液呈碱性的原因(用离子方程式表示)_____________________;常温下,0.1mol/L该溶液中离子浓度由大到小排列___________(用离子符号表示)。
(7)常温下,NaHSO3溶液呈酸性,在Na2SO3溶液中滴加稀盐酸至中性时,溶质的主要成分有__________________。(用化学式表示)。