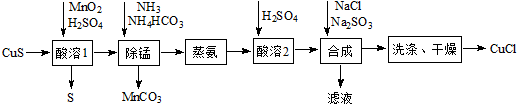
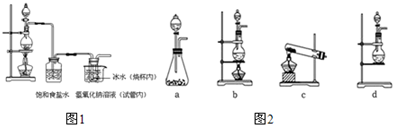
题目内容
15.下列离子方程式正确的是( )| A. | 将Cl2通入NaOH溶液中:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 铜和稀硝酸的反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 钢铁吸氧腐蚀的正极反应:4OH--4e-═O2↑+2H2O | |
| D. | 将少量SO2通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO |
分析 A.二者反应生成氯化钠、次氯酸钠和水;
B.二者反应生成硝酸铜、一氧化氮和水;
C.钢铁吸氧腐蚀的正极发生还原反应;
D.次氯酸根离子具有强的氧化性,能够氧化二氧化硫生成硫酸根离子.
解答 解:A.将Cl2通入NaOH溶液中,离子方程式:Cl2+2OH-═Cl-+ClO-+H2O,故A正确;
B.铜和稀硝酸的反应,离子方程式:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故B正确;
C.钢铁吸氧腐蚀的正极反应,离子方程式:2H2O+O2+4e-═4OH-,故C错误;
D.将少量SO2气体通入NaClO溶液中,二氧化硫被氧化成硫酸根离子,正确的离子方程式为:ClO-+H2O+SO2═SO42-+2H++Cl-,故D错误;
故选AB.
点评 本题考查了离子方程式的书写,侧重考查了复分解、氧化还原反应的离子方程式书写,明确物质的性质是解题关键,注意钢铁吸氧腐蚀原理,题目难度中等.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目
6.将浓度为0.1mol•L-1 HF溶液加水不断稀释,下列说法正确的是( )
| A. | c(H+) 增大 | B. | Ka(HF)增大 | C. | $\frac{c({F}^{-})}{c({H}^{+})}$减小 | D. | $\frac{c({H}^{+})}{c(HF)}$减小 |
3.向溶液中分别通入足量的相应气体后,下列各组离子还能大量存在的是( )
| A. | 氯气:K+、Na+、AlO2-、CO32- | B. | 二氧化硫:Na+、NH4+、SO32-、Cl- | ||
| C. | 氯化氢:H+、K+、MnO4-、SO42- | D. | 二氧化碳:Mg2+、Al3+、Cl-、NO3- |
10.对A、B、C三种金属活动性的实验研究过程如下:
(1)取大小相等的三种金属片,分别放入CuSO4溶液中,一段时间后,A、C表面出现红色物质,B表面没有现象.
(2)取大小相等的A、C两种金属片,分别放入相同的稀盐酸中,A、C表面都产生气泡,但A产生气泡的速度明显比C的快.
则A、B、C三种金属的活动性顺序是( )
(1)取大小相等的三种金属片,分别放入CuSO4溶液中,一段时间后,A、C表面出现红色物质,B表面没有现象.
(2)取大小相等的A、C两种金属片,分别放入相同的稀盐酸中,A、C表面都产生气泡,但A产生气泡的速度明显比C的快.
则A、B、C三种金属的活动性顺序是( )
| A. | A>C>B | B. | C>A>B | C. | C>B>A | D. | A>B>C |
20.下列说法不正确的是( )
| A. | 油脂属于酯类,在酸性或碱性条件下与水发生水解反应,称为皂化反应 | |
| B. | 淀粉、纤维素没有甜味,它们都是天然高分子化合物,在一定条件下水解都能生成葡萄糖 | |
| C. | 鸡蛋清的溶液中加入硫酸铜溶液,鸡蛋清凝聚,蛋白质变性 | |
| D. | 氨基酸分子中都含有-COOH和-NH2二种原子团,能相互反应形成更复杂的多肽化合物 |
5.设NA是阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L乙醇中含有的氧原子数为NA | |
| B. | 64g的S2和S8混合物中,含硫原子总数为2 NA | |
| C. | 1L 1mol/L氯化铁溶液中,含有NA个Fe3+ | |
| D. | 25℃时,pH=13的Ba(OH)2溶液中含有OH-数目为2NA |