题目内容
将Cl2通入熔融的硫磺制得S2Cl2,S2Cl2是黄红色油状发烟液体,遇水分解出无色有刺激性气味的气体,且溶液变浑浊;S2Cl2与NaOH 溶液反应得到澄清溶液.S2Cl2在合成橡胶,硬水软化等方面有着重要应用.有关S2Cl2的叙述正确的有( )
| A、S2Cl2的结构简式:Cl-S-S-Cl |
| B、S2Cl2和水反应中,氧化剂还原剂物质的量之比为1:1 |
| C、S2Cl2和NaOH水溶液反应,氧化与还原产物物质的量之比为1:1 |
| D、13.5g S2Cl2和NaOH反应电子转移数为0.1NA |
考点:氧化还原反应,不同晶体的结构微粒及微粒间作用力的区别
专题:氧化还原反应专题
分析:A.S2Cl2分子中各原子最外层均满足8电子稳定结构,电子式为 ;
;
B.反应为2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑,S元素的化合价既升高又降低;
C.发生反应为S2Cl2+6NaOH=Na2S+Na2SO3+2NaCl+3H2O,Na2S为还原产物,Na2SO3为氧化产物;
D.n(S2Cl2)=
=0.1mol,结合元素的化合价计算转移电子.
 ;
;B.反应为2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑,S元素的化合价既升高又降低;
C.发生反应为S2Cl2+6NaOH=Na2S+Na2SO3+2NaCl+3H2O,Na2S为还原产物,Na2SO3为氧化产物;
D.n(S2Cl2)=
| 13.5g |
| 135g/mol |
解答:
解:A.S2Cl2分子中各原子最外层均满足8电子稳定结构,电子式为 ,则结构简式为Cl-S-S-Cl,故A正确;
,则结构简式为Cl-S-S-Cl,故A正确;
B.反应为2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑,S元素的化合价既升高又降低,生成S时作氧化剂,生成二氧化硫作还原剂,则由S原子守恒可知,氧化剂还原剂物质的量之比为3:1,故B错误;
C.发生反应为S2Cl2+6NaOH=Na2S+Na2SO3+2NaCl+3H2O,Na2S为还原产物,Na2SO3为氧化产物,则由反应可知氧化与还原产物物质的量之比为1:1,故C正确;
D.n(S2Cl2)=
=0.1mol,由元素的化合价变化可知转移电子为0.1mol×(4-1)×NA=0.3NA,故D错误;
故选AC.
 ,则结构简式为Cl-S-S-Cl,故A正确;
,则结构简式为Cl-S-S-Cl,故A正确;B.反应为2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑,S元素的化合价既升高又降低,生成S时作氧化剂,生成二氧化硫作还原剂,则由S原子守恒可知,氧化剂还原剂物质的量之比为3:1,故B错误;
C.发生反应为S2Cl2+6NaOH=Na2S+Na2SO3+2NaCl+3H2O,Na2S为还原产物,Na2SO3为氧化产物,则由反应可知氧化与还原产物物质的量之比为1:1,故C正确;
D.n(S2Cl2)=
| 13.5g |
| 135g/mol |
故选AC.
点评:本题考查氧化还原反应,为高中奥林匹克竞赛题,把握习题中的信息及反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意判断发生的氧化还原反应,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列有关表达正确的是( )
A、热化学方程式C2H2(g)+
| ||
| B、H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ/mol,表示含1molNaOH的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3 kJ的热量 | ||
| C、少量的钠投入足量的水中:2Na+2H2O═2Na++2OH-+H2↑ | ||
| D、向明矾KAl(SO4)2溶液中滴入氢氧化钡溶液,至SO42-恰好沉淀完全:Al3++2SO42-+2Ba2++3OH-═2BaSO4↓+Al(OH)3↓ |
把0.02mol/L HAc溶液和0.01mol/L NaOH溶液等体积混合,则混合溶液中微粒浓度关系正确的是( )
| A、c(Ac-)>c(Na+) |
| B、c(HAc)>c(Ac-) |
| C、2c(H+)=c(Ac-)-c(HAc) |
| D、c(HAc)+c(Ac-)=0.01mol?L-1 |
下列关于摩尔质量的论述正确的是( )
| A、氢的摩尔质量是1g/mol |
| B、1个氮分子的摩尔质量为28g |
| C、水的摩尔质量为18g |
| D、NO3- 的摩尔质量为62g/mol |
已知某两种物质在光照条件下能发生化学反应,其微观示意图如下:则下列说法中正确的是( )
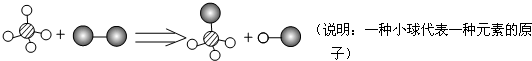

| A、图示中的反应物都是单质 |
| B、该反应属于置换反应 |
| C、图示中共有4种物质 |
| D、该图示不符合质量守恒定律 |
下列物质中,物质的量为0.5mol的是( )
| A、3.01×1022个铁原子 |
| B、8g氧气 |
| C、61.25g氯酸钾 |
| D、1.51×1023个氧分子 |
