题目内容
填空:
(1)用电子式表示H2O和MgBr2的形成过程H2O
MgBr2
(2)写出CO2、Na2O2、H2O2的电子式:CO2 Na2O2 HClO
(3)依据事实,写出下列反应的热化学方程式.
①若适量的N2和O2完全反应,如果生成23g NO2需要吸收16.95kJ热量,则表示该反应的热化学方程式为
②已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H1=-25kJ/mol①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H2=-47kJ/mol②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H3=+19kJ/mol③
请写出CO还原FeO的热化学方程式: .
(1)用电子式表示H2O和MgBr2的形成过程H2O
MgBr2
(2)写出CO2、Na2O2、H2O2的电子式:CO2
(3)依据事实,写出下列反应的热化学方程式.
①若适量的N2和O2完全反应,如果生成23g NO2需要吸收16.95kJ热量,则表示该反应的热化学方程式为
②已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H1=-25kJ/mol①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H2=-47kJ/mol②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H3=+19kJ/mol③
请写出CO还原FeO的热化学方程式:
考点:用盖斯定律进行有关反应热的计算,电子式,用电子式表示简单的离子化合物和共价化合物的形成
专题:
分析:(1)水是共价化合物,分子中氢原子与氧原子之间形成1对共用电子对,用电子式表示其形成过程时,左边是原子的电子式,右边为水分子的电子式,中间用箭头连接;溴化镁是离子化合物,由钠离子与镁离子构成,用电子式表示其形成过程时,左边是原子的电子式,右边为溴化镁的电子式,中间用箭头连接;
(2)二氧化碳中存在两个碳氧双键,C、O原子最外层都达到最外层8个电子;过氧化钠为离子化合物,钠离子用离子符号表示,阴离子需要标出所带电荷及最外层电子;HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键;
(3)①根据每生成23克NO2需要吸收16.95kJ热量,计算2molNO2燃烧放出的热量,结合化学方程式书写热化学方程式;
②已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),△H1=-25KJ/mol…①,
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g),△H2=-47KJ/mol…②,
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g),△H3=19KJ/mol…③,
根据盖斯定律将方程式变形(3×①-②-2×③)÷6得:
Fe(s)+CO(g)═Fe(s)+CO2(g),△H.
(2)二氧化碳中存在两个碳氧双键,C、O原子最外层都达到最外层8个电子;过氧化钠为离子化合物,钠离子用离子符号表示,阴离子需要标出所带电荷及最外层电子;HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键;
(3)①根据每生成23克NO2需要吸收16.95kJ热量,计算2molNO2燃烧放出的热量,结合化学方程式书写热化学方程式;
②已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),△H1=-25KJ/mol…①,
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g),△H2=-47KJ/mol…②,
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g),△H3=19KJ/mol…③,
根据盖斯定律将方程式变形(3×①-②-2×③)÷6得:
Fe(s)+CO(g)═Fe(s)+CO2(g),△H.
解答:
解:(1)H2O为共价化合物,分子中氢原子与氧原子之间形成1对共用电子对,用电子式表示形成过程为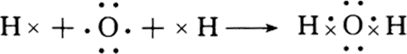 ,
,
溴化镁是离子化合物,由钠离子与镁离子构成,用电子式表示的形成过程为 ,
,
故答案为: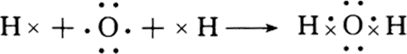 ;
;
 ;
;
(2)二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: ;
;
Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,氧原子得到电子形成过氧根阴离子,电子式为 ;
;
HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键,次氯酸的电子式为: ;
;
故答案为: ;
; ;
; ;
;
(3)①适量的N2和O2完全反应,每生成23克NO2需要吸收16.95 kJ热量,所以每生成92克NO2需要吸收67.8kJ热量,则热化学方程式为:N2(g)+2O2(g)=2NO2(g)△H=+67.8kJ/mol,
故答案为:N2(g)+2O2(g)═2NO2(g)△H=+67.8kJ/mol;
②Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),△H1=-25KJ/mol…①,
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g),△H2=-47KJ/mol…②,
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g),△H3=19KJ/mol…③,
根据盖斯定律将方程式变形(3×①-②-2×③)÷6得:Fe(s)+CO(g)═Fe(s)+CO2(g),△H=(3×△H1-△H2-2×△H3)÷6=-11KJ/mol.
故答案为:FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11KJ/mol.
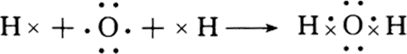 ,
,溴化镁是离子化合物,由钠离子与镁离子构成,用电子式表示的形成过程为
 ,
,故答案为:
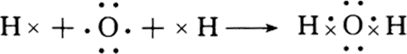 ;
; ;
;(2)二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为:
 ;
;Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,氧原子得到电子形成过氧根阴离子,电子式为
 ;
;HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键,次氯酸的电子式为:
 ;
;故答案为:
 ;
; ;
; ;
;(3)①适量的N2和O2完全反应,每生成23克NO2需要吸收16.95 kJ热量,所以每生成92克NO2需要吸收67.8kJ热量,则热化学方程式为:N2(g)+2O2(g)=2NO2(g)△H=+67.8kJ/mol,
故答案为:N2(g)+2O2(g)═2NO2(g)△H=+67.8kJ/mol;
②Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),△H1=-25KJ/mol…①,
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g),△H2=-47KJ/mol…②,
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g),△H3=19KJ/mol…③,
根据盖斯定律将方程式变形(3×①-②-2×③)÷6得:Fe(s)+CO(g)═Fe(s)+CO2(g),△H=(3×△H1-△H2-2×△H3)÷6=-11KJ/mol.
故答案为:FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11KJ/mol.
点评:本题考查了电子式的表示方法及其综合应用、热化学方程式的书写,题目难度较大,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用基础知识的能力,注意掌握离子化合物与共价化合物的电子式的表示方法.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
能使蛋白质变性的是( )
①硫酸钾 ②紫外线照射 ③氯酸钾 ④硝酸汞 ⑤氯化铵 ⑥氢氧化钠.
①硫酸钾 ②紫外线照射 ③氯酸钾 ④硝酸汞 ⑤氯化铵 ⑥氢氧化钠.
| A、②④⑥ | B、①③⑤ |
| C、①②③ | D、③④⑤ |
与反应速率无关的是( )
| A、浓度 | B、密度 | C、催化剂 | D、温度 |
近年来,赤潮直接威胁着人类生存的环境,已经成为我国目前最主要的海洋灾害之一.下列关于赤潮发生原因的叙述正确的是( )
| A、含氯化合物直接排入大海,引发赤潮的发生 |
| B、赤潮发生的根本原因是含氟制冷剂大量使用导致臭氧层破坏的结果 |
| C、含氮、磷的大量污水任意排放是导致赤潮直接原因 |
| D、空气中二氧化碳浓度升高,导致海洋温度升高,引发了赤潮的发生 |
下列离子在指定介质中能大量共存的是( )
| A、氨水:Na+,K+,Cl-,HCO3- |
| B、KI溶液:K+,H+,MnO4-,NO3- |
| C、稀硝酸:Fe3+,Mg2+,Cl-,SO42- |
| D、沸水:Na+,Mg2+,HCO3-,Cl- |
 某同学组装了如图所示的电化学装置,电极Ⅰ为Zn,电极Ⅱ为Cu,其他电极均为石墨,则下列说法正确的是( )
某同学组装了如图所示的电化学装置,电极Ⅰ为Zn,电极Ⅱ为Cu,其他电极均为石墨,则下列说法正确的是( )A、电流方向:电极Ⅳ→ →电极Ⅰ →电极Ⅰ |
| B、盐桥中K+会移向ZnSO4溶液 |
| C、电极Ⅲ处得到标况下气体2.24L,电极Ⅱ析出6.4g固体 |
| D、NaCl溶液中,电极Ⅲ制得氯气,电极Ⅳ制得金属钠 |
某些化学键的键能数据如下表所示(kJ?mol-1):
分析上表中数据,下列结论正确的是( )
| 键 | H-H | Br-Br | I-I | Cl-Cl | H-Cl | H-I | H-Br |
| 键能 | 436 | 193 | 151 | 247 | 431 | 299 | 356 |
| A、把1mol Cl2分解为气态原子时,需要放出247 kJ能量 |
| B、由表中所列化学键形成的单质分子中,最稳定的是H2,形成的化合物分子中,最不稳定的是HI |
| C、在一定条件下,1mol H2 与足量的Cl2、Br2、I2 分别反应,放出热量由多到少的是I2>Br2>Cl2 |
| D、预测1mol H2 在足量F2 中燃烧比在Cl2中放热少 |
下列粒子半径之比小于1的是( )
| A、r (Na+)/r (Na) |
| B、r (Cl-)/r (Cl) |
| C、r (Na)/r (Mg) |
| D、r (Ca)/r (Mg) |
下列物质的电子式书写正确的是( )
A、NaCl  |
B、H2S  |
C、氮气  |
D、NH4I  |