题目内容
下列电离方程式,书写错误的是( )
| A、Ca(OH)2═Ca2++2OH- |
| B、NaHCO3═Na++H++CO32- |
| C、KHSO4═K++H++SO42- |
| D、Al2(SO4)3═2Al3++3SO42- |
| E、Al2(SO4)3═2Al3++3SO42- |
考点:电离方程式的书写
专题:电离平衡与溶液的pH专题
分析:用化学式和离子符号表示电离过程的式子,称为电离方程式,电离方程式中,离子所带电荷数一般可根据它们在化合物中的化合价来判断,所有阳离子带的正电荷总数与所有阴离子所带的负电荷总数相等,离子团不能拆开.弱电解质的电离用“?”,强电解质的电离用“═”,以此来解答.
A.此电离方程式书写正确,所有阳离子带的正电荷总数与所有阴离子所带的负电荷总数相等;
B.碳酸氢钠为强电解质,完全电离出钠离子和碳酸氢根离子;
C.硫酸氢钾,完全电离电离出钾离子和氢离子和硫酸根离子;
D.Al2(SO4)3为强电解质完全电离出铝离子和硫酸根离子.
A.此电离方程式书写正确,所有阳离子带的正电荷总数与所有阴离子所带的负电荷总数相等;
B.碳酸氢钠为强电解质,完全电离出钠离子和碳酸氢根离子;
C.硫酸氢钾,完全电离电离出钾离子和氢离子和硫酸根离子;
D.Al2(SO4)3为强电解质完全电离出铝离子和硫酸根离子.
解答:
解:A.氢氧化钙是强碱,完全电离出钙离子和氢氧根离子,即Ca(OH)2=Ca2++2OH-,故A正确;
B.碳酸氢钠在水中电离出钠离子和碳酸氢根离子,电离方程式为NaHCO3═Na++HCO3-,故B错误;
C.KHSO4是强电解质,NaHSO4在水中电离出钾离子和硫酸根离子和氢离子,KHSO4═K++H++SO42-,故C正确;
D.Al2(SO4)3为强电解质完全电离,Al2(SO4)3═2Al3++3SO42-,电离方程式书写正确,故D正确;
故选B.
B.碳酸氢钠在水中电离出钠离子和碳酸氢根离子,电离方程式为NaHCO3═Na++HCO3-,故B错误;
C.KHSO4是强电解质,NaHSO4在水中电离出钾离子和硫酸根离子和氢离子,KHSO4═K++H++SO42-,故C正确;
D.Al2(SO4)3为强电解质完全电离,Al2(SO4)3═2Al3++3SO42-,电离方程式书写正确,故D正确;
故选B.
点评:本题考查电离方程式的书写知识,注意强电解质在溶液中能完全电离,弱电解质部分电离,离子团在电离方程式中不能拆开,强酸的酸式根离子要拆开,弱酸的酸式根离子不能拆开,KHSO4电离为该题易错点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
Na2CO3、CaCO3、BaCO3、CuCO3等碳酸盐都能与相同浓度的稀硫酸反应放出CO2,其中反应最为缓慢的是( )
| A、Na2CO3 |
| B、CaCO3 |
| C、BaCO3 |
| D、CuCO3 |
下列各组中互为同位素的是( )
| A、O2和O3 |
| B、1H 和 2H |
| C、H2O和H2O2 |
| D、O2-和O |
胶体区别于溶液最本质的特征是( )
| A、分散质粒子的直径大小 |
| B、有无丁达尔效应 |
| C、分散质粒子是否带电荷 |
| D、能否通过滤纸 |
用价层电子对互斥理论预测H2O和CH4的立体结构两个结论都正确的是( )
| A、直线形,三角锥形 |
| B、V形,三角锥形 |
| C、直线形,正四面体形 |
| D、V形,正四面体形 |
下列说法正确的是(NA表示阿伏加德罗常数的值)( )
①28g氮气所含有的原子数目为NA
②4g金属钙变成钙离子时失去的电子数目为0.1NA
③在常温常压下,11.2L N2含有的分子数为0.5NA
④在标况下 1mol Ne含有的原子数为NA
⑤0.5mol单质铝与足量盐酸反应转移电子数为1.5NA
⑥标准状况下,1L水所含分子数为
4NA
⑦17g氨气所含电子数目为10NA.
①28g氮气所含有的原子数目为NA
②4g金属钙变成钙离子时失去的电子数目为0.1NA
③在常温常压下,11.2L N2含有的分子数为0.5NA
④在标况下 1mol Ne含有的原子数为NA
⑤0.5mol单质铝与足量盐酸反应转移电子数为1.5NA
⑥标准状况下,1L水所含分子数为
| 1 |
| 22 |
⑦17g氨气所含电子数目为10NA.
| A、①②⑤⑥⑦ | B、①②④⑤⑥ |
| C、⑤⑦ | D、④⑤⑦ |
下列化合物中,常温下能被空气氧化的是( )
A、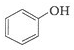 |
B、 |
C、 |
| D、CH4 |
下列变化不属于氧化还原反应的是( )
| A、铁生锈 | B、炉子生火 |
| C、煤燃烧 | D、石灰水变浑 |