题目内容
19.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g);△H=-192.9kJ•mol-1
下列说法正确的是( )
| A. | CH3OH的标准燃烧热为△H=-192.9 kJ•mol-1 | |
| B. | 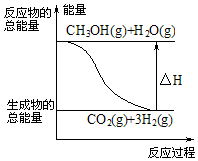 反应①中的能量变化如图所示 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应:CH3OH(l)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ•mol-1 |
分析 A.利用盖斯定律,②×3-①×2可得甲醇燃烧的热化学方程式,进而可知甲醇的燃烧热;
B.反应①为吸热反应,反应物总能量小于生成物总能量;
C.根据已知的甲醇转化为氢气的两种反应原理来判断;
D.根据物质的能量大小与物质的状态关系来判断.
解答 解:A.甲醇燃烧应生成二氧化碳和水,故A错误;
B.反应①为吸热反应,反应物总能量小于生成物总能量,故B错误;
C.由已知可知,反应①为吸热反应,而反应②为放热反应,故C错误;
D.同物质的量的同种物质,气态能量最高,其次液态能量,固态能量最低,由②推知反应:CH3OH(l)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ•mol-1,故D正确.
故选D.
点评 本题考查化学反应的反应热的计算,为高频考点,侧重于学生的分析能力的考查,注意在比较反应热大小时要带符号比较,并注意盖斯定律的应用来解答.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
9.下列说法中,符合ⅦA族元素结构与性质特征的是( )
| A. | 原子易形成-2价阴离子 | |
| B. | 单质均为双原子分子,具有氧化性 | |
| C. | 原子半径随原子序数递增逐渐减小 | |
| D. | 氢化物的稳定性随原子序数递增依次增强 |
10.下列关于化学反应速率的说法中,不正确的是( )
| A. | 反应速率用于衡量化学反应进行的快慢 | |
| B. | 决定反应速率的主要因素是反应物的性质 | |
| C. | 反应速率越大,反应现象就一定越明显 | |
| D. | 增大反应物的浓度、提高反应温度都能增大反应速率 |
7.下列说法正确的是( )
| A. | 用试管夹夹试管应从试管底往上套,拇指按在试管夹的短柄上 | |
| B. | 装碘的试剂瓶中残留的碘可以用酒精洗涤 | |
| C. | 配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2 cm处,用滴管滴加蒸馏水到刻度线 | |
| D. | 定容时,俯视刻度线,会使所配溶液的浓度偏低 |
11.下列关于官能团的判断中说法不正确的是( )
| A. | 醇的官能团是羟基(-OH) | B. | 酚的官能团是羟基(-OH) | ||
| C. | 醛的官能团是醛基(-CHO) | D. | 羧酸的官能团是羟基(-OH) |
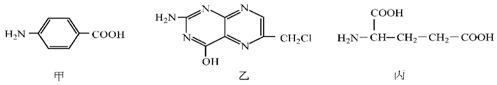
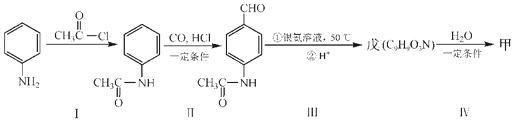
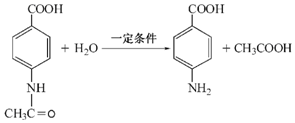 .
.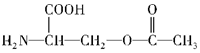 .
.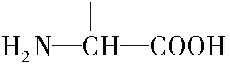 b.在稀硫酸中水解有乙酸生成.
b.在稀硫酸中水解有乙酸生成.