题目内容
20.下列叙述正确的是( )| A. | 胶体区别于其他分散系的本质特征是胶体具有丁达尔现象 | |
| B. | NaCl溶液在电流的作用下电离成Na+与Cl- | |
| C. | 2NO2+2NaOH═NaNO3+NaNO2+H2O是氧化还原反应 | |
| D. | 固体NaCl不导电,所以NaCl是非电解质 |
分析 A.胶体的本质特征为分散质的直径大小;
B.电离的条件为溶于水或熔化;
C.N元素的化合价变化;
D.NaCl在溶于水或熔化状态下均导电.
解答 解:A.胶体的本质特征为分散质的直径大小,而丁达尔现象为胶体的特有的性质,故A错误;
B.电离的条件为溶于水或熔化,与电流无关,故B错误;
C.N元素的化合价变化,为氧化还原反应,故C正确;
D.NaCl在溶于水或熔化状态下均导电,为电解质,故D错误;
故选C.
点评 本题考查较综合,为高频考点,把握氧化还原反应、电解质、胶体的性质为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
11.若 A+酸=盐+水,则A不可能属于( )
| A. | 氧化物 | B. | 胶体 | C. | 碱 | D. | 单质 |
8. 在一定温度和压强下,向盛有足量X的体积可变的密闭容器中通人Y气体,发生反应:X(s)+aY(g)?bZ(s)+W(g);△H>0平衡时Z的物质的量与通人Y的物质的量的变化关系如图所示.下列说法中正确的是( )
在一定温度和压强下,向盛有足量X的体积可变的密闭容器中通人Y气体,发生反应:X(s)+aY(g)?bZ(s)+W(g);△H>0平衡时Z的物质的量与通人Y的物质的量的变化关系如图所示.下列说法中正确的是( )
 在一定温度和压强下,向盛有足量X的体积可变的密闭容器中通人Y气体,发生反应:X(s)+aY(g)?bZ(s)+W(g);△H>0平衡时Z的物质的量与通人Y的物质的量的变化关系如图所示.下列说法中正确的是( )
在一定温度和压强下,向盛有足量X的体积可变的密闭容器中通人Y气体,发生反应:X(s)+aY(g)?bZ(s)+W(g);△H>0平衡时Z的物质的量与通人Y的物质的量的变化关系如图所示.下列说法中正确的是( )| A. | 平衡时Y的转化率为$\frac{a}{b}$% | |
| B. | 向容器中再加入少量X,则Y的转化率增大 | |
| C. | 再通入Y,重新达到平衡时W的体积分数不变 | |
| D. | 保持压强一定,当原反应在较高温度下建立平衡时,图中θ<45° |
5.下列实验操作均要用玻璃棒(①过滤;②蒸发;③溶解;④向容量瓶转移液体),其中玻璃棒的作用及其目的相同的是( )
| A. | ①② | B. | ①③ | C. | ①④ | D. | ③④ |
12.下列操作不正确的是( )
| A. | 实验室蒸馏石油时,将温度计的水银球插入液面下 | |
| B. | 稀释浓硫酸时,将浓硫酸沿玻璃棒慢慢注入盛有水的烧杯内并不断用玻璃棒搅拌 | |
| C. | 用蒸发皿蒸发液体时,未垫上石棉网直接加热蒸发皿 | |
| D. | 配制一定物质的量浓度的溶液时,清洗后未经干燥的容量瓶直接用于实验 |
9.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标准状况,1molH2O含O原子个数为NA | |
| B. | 1.12L N2中含N2分子数为0.05NA | |
| C. | 5.6gFe与足量稀盐酸反应,转移的电子数为0.3NA | |
| D. | 0.1molFeCl3可制得Fe(OH)3胶体的数目为0.1NA |
4.煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(1)已知:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-111kJ•mol-1 2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1.请写出水蒸气通过红热的碳产生水煤气的热化学方程式C(s)+H2O(g)?CO(g)+H2(g)△H=+131kJ•mol-1.一定温度下,在一个容积固定的密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是abce(填字母编号).
a.容器中的压强不变 b.1mol H-H键断裂的同时断裂2mol H-O键
c.v正(CO)=v逆(H2O) d.c(CO)=c(H2) e.容器中混合气体的密度不再改变
(2)将不同物质的量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如表中所示的三组数据:
①实验1中以v(CO2)表示的反应速率为0.16mol•(L•min)-1.
②该反应的逆反应为吸(填“吸”或“放”)热反应.
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),则a、b应满足的关系是b=2a,且a>1(用含a、b的代数式表示).
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图1表示该反应过程中能量的变化.
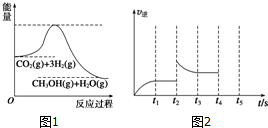
①在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使CH3OH的体积分数增大的是cde(填字母编号).
a.升高温度 b.充入He(g) c.将H2O(g)从体系中分离出来 d.再充入1mol CO2和3mol H2
e.将该密闭容器改为恒压密闭容器
②容器中反应的逆反应速率随时间变化的关系如图2.t2时改变了某一种条件,改变的条件可能是升高温度.(任写一点)
(1)已知:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-111kJ•mol-1 2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1.请写出水蒸气通过红热的碳产生水煤气的热化学方程式C(s)+H2O(g)?CO(g)+H2(g)△H=+131kJ•mol-1.一定温度下,在一个容积固定的密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是abce(填字母编号).
a.容器中的压强不变 b.1mol H-H键断裂的同时断裂2mol H-O键
c.v正(CO)=v逆(H2O) d.c(CO)=c(H2) e.容器中混合气体的密度不再改变
(2)将不同物质的量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如表中所示的三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/mi n | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②该反应的逆反应为吸(填“吸”或“放”)热反应.
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),则a、b应满足的关系是b=2a,且a>1(用含a、b的代数式表示).
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图1表示该反应过程中能量的变化.

①在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使CH3OH的体积分数增大的是cde(填字母编号).
a.升高温度 b.充入He(g) c.将H2O(g)从体系中分离出来 d.再充入1mol CO2和3mol H2
e.将该密闭容器改为恒压密闭容器
②容器中反应的逆反应速率随时间变化的关系如图2.t2时改变了某一种条件,改变的条件可能是升高温度.(任写一点)
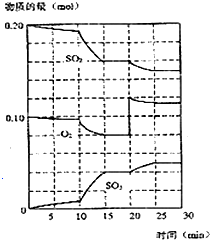 在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:2SO2(g)+O2(g)═2SO3(g)△H=-190kJ•mol-1
在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:2SO2(g)+O2(g)═2SO3(g)△H=-190kJ•mol-1