题目内容
按要求写出下列化学方程式:
(1)丙烯→聚丙烯 ;
(2)CaC2→乙炔 ;
(3)甲苯→TNT ;
(4)2-溴丙烷→2-丙醇 .
(1)丙烯→聚丙烯
(2)CaC2→乙炔
(3)甲苯→TNT
(4)2-溴丙烷→2-丙醇
考点:化学方程式的书写
专题:
分析:(1)丙烯发生加聚反应生成聚丙烯;
(2)CaC2和水反应生成乙炔和氢氧化钙;
(3)甲苯与浓硝酸、浓硫酸反应生成TNT;
(4)2-溴丙烷在氢氧化钠的水溶液中发生取代反应生成2-丙醇和溴化钠;
(2)CaC2和水反应生成乙炔和氢氧化钙;
(3)甲苯与浓硝酸、浓硫酸反应生成TNT;
(4)2-溴丙烷在氢氧化钠的水溶液中发生取代反应生成2-丙醇和溴化钠;
解答:
解:(1)丙烯发生加聚反应生成聚丙烯,化学方程式为: ,
,
故答案为:
(2)CaC2和水反应生成乙炔和氢氧化钙,反应的化学方程式为:CaC2+2H2O→CH≡CH↑+Ca(OH)2;
故答案为:CaC2+2H2O→CH≡CH↑+Ca(OH)2;
(3)甲苯与浓硝酸、浓硫酸反应生成TNT,该反应为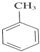 +3HNO3
+3HNO3
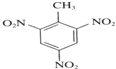 +3H2O,
+3H2O,
故答案为: +3HNO3
+3HNO3
 +3H2O;
+3H2O;
(4)2-溴丙烷在氢氧化钠的水溶液中发生取代反应生成2-丙醇和溴化钠;
反应的化学方程式为:CH3-CHBr-CH3+NaOH
CH3-CH(OH)-CH3↑+NaBr;
故答案为:CH3-CHBr-CH3+NaOH
CH3-CH(OH)-CH3↑+NaBr;
 ,
,故答案为:

(2)CaC2和水反应生成乙炔和氢氧化钙,反应的化学方程式为:CaC2+2H2O→CH≡CH↑+Ca(OH)2;
故答案为:CaC2+2H2O→CH≡CH↑+Ca(OH)2;
(3)甲苯与浓硝酸、浓硫酸反应生成TNT,该反应为
 +3HNO3
+3HNO3| 浓H2SO4 |
| △ |
 +3H2O,
+3H2O,故答案为:
 +3HNO3
+3HNO3| 浓H2SO4 |
| △ |
 +3H2O;
+3H2O;(4)2-溴丙烷在氢氧化钠的水溶液中发生取代反应生成2-丙醇和溴化钠;
反应的化学方程式为:CH3-CHBr-CH3+NaOH
| 水 |
| △ |
故答案为:CH3-CHBr-CH3+NaOH
| 水 |
| △ |
点评:本题考查了化学方程式的书写方法是原子守恒,正确书写产物,配平化学方程式是解题关键.

练习册系列答案
相关题目
下列有关胶体的性质,说法错误的是( )
| A、胶体与其他分散系的本质区别在于分散质粒子的大小不同 |
| B、向沸水中加入几滴饱和FeCl3溶液煮沸至溶液呈红褐色,可得Fe(OH)3胶体 |
| C、当光束通过溶液时,可以看到一条光亮的“通路” |
| D、明矾作为净水剂的原因是形成氢氧化铝的胶体具有很强的吸附性 |
在相同温度下,有两种稀醋酸溶液甲和乙,都已达到电离平衡状态.测得平衡时甲溶液中c(CH3COOH)=amol?L-1,电离度为α1,乙溶液中c(CH3COO-)=a mol?L-1,电离度为α2.下列叙述中正确的是( )
| A、水的电离程度:甲>乙 |
| B、pH:甲<乙 |
| C、电离度:α2>α1 |
| D、甲溶液的c(H+)是乙溶液c(H+)的0.5α1倍 |
两份质量均为a g的硫,在一定条件下分别跟足量的氢气和氧气完全反应,反应后将生成物混合,析出硫的质量为( )
| A、2a g | B、a g |
| C、1.5a g | D、0.5a g |
关于分液操作叙述正确的是 ( )
| A、水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞.将分液漏斗倒转过来,用力振摇 |
| B、振摇几次后需打开分液漏斗上口的玻璃塞放气 |
| C、经几次振摇并放气后,手持分液漏斗静置待液体分层 |
| D、放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔 |