题目内容
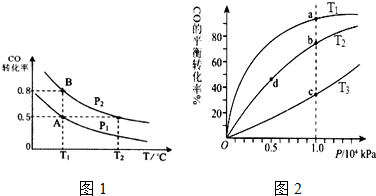
9.一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)≒Y(g)+Z(g),达到反应限度的标志是( )| A. | 反应容器中压强不再变化 | |
| B. | X的分解速率与X的生成速率相等 | |
| C. | X、Y、Z的浓度之比为2:1:1 | |
| D. | 单位时间内生成1molY的同时生成1molZ |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、反应是前后系数和不变的反应,反应容器中压强不再变化不能作为反应平衡的判据,故A错误;
B、X的分解速率与X的生成速率相等,说明正逆反应速率相等,达化学平衡状态,故B正确;
C、X、Y与Z的物质的量之比为2:1:1,而不是量不变,不能作为反应平衡的判据,故C错误;
D、单位时间内生成1molY的同时生成1molZ,只表明正反应方向,故D错误.
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
19.下列化合物在一定条件下,既能发生消去反应又能发生水解反应的是( )
| A. | CH3Cl | B. |  | C. |  | D. |  |
20.下列现象没有发生化学变化的是( )
| A. | 蛋白质遇浓硝酸变黄 | B. | 焰色反应 | ||
| C. | 用石灰水粉刷的墙壁逐渐变白 | D. | 碘遇淀粉变蓝 |
4.碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.以海带为原料提取碘的工艺流程如图1所示:

回答下列问题:
(1)步骤①灼烧海带时,除三脚架、坩埚、坩埚钳、酒精灯外,还需要用到的实验仪器有泥三角.
(2)步骤③的实验操作名称为过滤;步骤④中反应的离子方程式为2I-+MnO2+4H+═Mn2++I2+2H2O.
(3)下列有关步骤⑤中分液漏斗的使用方法表述合理的有bd(填字母)
a.分液漏斗使用前必须要检漏,只要旋塞处不漏水即可使用
b.萃取时振摇放气操作应如图2所示
c.静置分层后,先放出下层液体,然后继续从下口放出上层液体
d.放出下层液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔
(4)步骤⑥中若采用蒸馏方法是不合适的,理由是碘易升华,会导致碘的损失.
(5)某兴趣小组用电位滴定法测定海带中碘的含量,测得的电动势(E)反映溶液中c(I-)的变化.该小组同学称取a g海带,经过步骤①②③操作得到含I-水溶液b mL,取100.00mL该溶液至滴定池,用0.01000mol•L-1的AgNO3标准溶液滴定,测得的部分数据如下表:
该次滴定终点时用去AgNO3溶液的体积为20.00mL,计算得出海带中碘元素的质量分数为$\frac{254b×1{0}^{-6}}{a}$×100%.
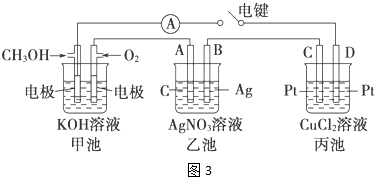
(6)以碘为原料,通过电解制备碘酸钾的实验装置如图3所示.电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH═5KI+KIO3+3H2O.将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却.电解时,阳极上发生反应的电极反应式为I-+6OH--6e-=IO3-+3H2O;电解时保持电流恒定,升高温度,电解反应速率将不变(填“变大”“变小”“不变”).

回答下列问题:
(1)步骤①灼烧海带时,除三脚架、坩埚、坩埚钳、酒精灯外,还需要用到的实验仪器有泥三角.
(2)步骤③的实验操作名称为过滤;步骤④中反应的离子方程式为2I-+MnO2+4H+═Mn2++I2+2H2O.
(3)下列有关步骤⑤中分液漏斗的使用方法表述合理的有bd(填字母)
a.分液漏斗使用前必须要检漏,只要旋塞处不漏水即可使用
b.萃取时振摇放气操作应如图2所示
c.静置分层后,先放出下层液体,然后继续从下口放出上层液体
d.放出下层液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔
(4)步骤⑥中若采用蒸馏方法是不合适的,理由是碘易升华,会导致碘的损失.
(5)某兴趣小组用电位滴定法测定海带中碘的含量,测得的电动势(E)反映溶液中c(I-)的变化.该小组同学称取a g海带,经过步骤①②③操作得到含I-水溶液b mL,取100.00mL该溶液至滴定池,用0.01000mol•L-1的AgNO3标准溶液滴定,测得的部分数据如下表:
| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
(6)以碘为原料,通过电解制备碘酸钾的实验装置如图3所示.电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH═5KI+KIO3+3H2O.将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却.电解时,阳极上发生反应的电极反应式为I-+6OH--6e-=IO3-+3H2O;电解时保持电流恒定,升高温度,电解反应速率将不变(填“变大”“变小”“不变”).
14.下列物质中,有共价键的化合物是( )
| A. | N2 | B. | CH4 | C. | NaCl | D. | MgCl2 |
1.为了使AlCl3溶液中的Al3+完全变为Al(OH)3沉淀,最好滴入( )
| A. | NaOH溶液 | B. | Ba(OH)2溶液 | C. | 氨水 | D. | KOH溶液 |
18.下列化学用语正确的是( )
| A. | 氯化钠的电子式: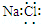 | |
| B. | 聚乙烯的结构简式: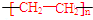 | |
| C. | 硫离子的结构示意图: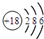 | |
| D. | 碳酸氢铵的电离方程式:NH4HCO3=NH4++H++CO32ˉ |
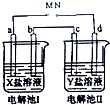 下图所示的电解池Ⅰ和Ⅱ溶液体积均为100mL,a、b和d均为Pt电极.电解过程中,电极b和d质量均增大.
下图所示的电解池Ⅰ和Ⅱ溶液体积均为100mL,a、b和d均为Pt电极.电解过程中,电极b和d质量均增大.